题目内容
(1)已知在25℃时,Ksp[Mg(OH)2]=3.2×10-11,假设饱和Mg﹙OH)2溶液的浓度为1g/mL,则Mg﹙OH﹚2的溶解度为 g.
(2)在25℃时,向0.02mol?L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为 mol?L-1.
(3)25℃时,向浓度均为0.02mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成沉淀 (填化学式);当两种沉淀共存时,
= .(已知25℃时,Ksp[Cu(OH)2]=2.2×10-20)
(2)在25℃时,向0.02mol?L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为
(3)25℃时,向浓度均为0.02mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成沉淀
| c(Mg2+) |
| c(Cu2+) |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:(1)据溶度积计算c[Mg﹙OH﹚2],可计算100mL溶液中氢氧化镁的质量,进而计算溶解度;
(2)如果溶液中Qc>Ksp[Mg(OH)2]就能产生沉淀,c(OH-)=
;
(3)溶度积常数越小的越先产生沉淀,当两种沉淀共存时,
=
:
=Ksp[Mg(OH)2]:Ksp[Cu(OH)2].
(2)如果溶液中Qc>Ksp[Mg(OH)2]就能产生沉淀,c(OH-)=
|
(3)溶度积常数越小的越先产生沉淀,当两种沉淀共存时,
| c(Mg2+) |
| c(Cu2+) |
| Ksp[Mg(OH)2] |
| c2(OH-) |
| Ksp[Cu(OH)2] |
| c2(OH-) |
解答:
解:(1)设饱和溶液Mg﹙OH﹚2的物质的量浓度为c,则c(Mg2+)×c2(OH-)=4c3=3.2×10-11,c=2×10-4mol/L,假设饱和Mg﹙OH﹚2溶液的浓度为1g/mL,则100mL溶液的质量为100g,含有溶质的质量为2×10-4mol/L×0.1L×58g/mol=1.16×10-3 g,故答案为:1.16×10-3 ;
(2)如果溶液中Qc>Ksp[Mg(OH)2]就能产生沉淀,c(OH-)=
=
mol/L=4×10-5 mol/L,故答案为:4×10-5;
(3)溶度积常数越小的越先产生沉淀,所以先生成沉淀的是Cu(OH)2,当两种沉淀共存时,
=
:
=Ksp[Mg(OH)2]:Ksp[Cu(OH)2]=3.2×10-11:2.2×10-20=1.6×109:1.1,故答案为:Cu(OH)2;1.6×109:1.1.
(2)如果溶液中Qc>Ksp[Mg(OH)2]就能产生沉淀,c(OH-)=
|
|
(3)溶度积常数越小的越先产生沉淀,所以先生成沉淀的是Cu(OH)2,当两种沉淀共存时,
| c(Mg2+) |
| c(Cu2+) |
| Ksp[Mg(OH)2] |
| c2(OH-) |
| Ksp[Cu(OH)2] |
| c2(OH-) |
点评:本题考查难溶物的溶解平衡有关计算,侧重考查计算能力,正确理解溶度积常数、饱和溶液即可解答,题目难度中等.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
下列有关实验的叙述,正确的是( )
| A、用量筒量取5.00mL 1.00mol?L-1盐酸于50mL容量瓶中,加水稀释至刻度可配制0.100mol?L-1盐酸 |
| B、用10mL的量筒准确量取9.50mL水 |
| C、向碘水中加入CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
| D、稀释浓硫酸时将水倒入浓硫酸中进行搅拌 |
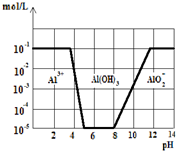 常温下,在0.1mol?L-1KAl(SO4)2溶液中,加入KOH固体,如图,横坐标
常温下,在0.1mol?L-1KAl(SO4)2溶液中,加入KOH固体,如图,横坐标为溶液的pH,纵坐标为Al3+离子或AlO2-离子的物质的量浓度.(假设Al3+
离子浓度为10-5mol?L-1时,Al3+离子已沉淀完全),下列说法不正确的是( )
| A、从图中数据计算可得Al(OH)3的溶度积Ksp=10-23 |
| B、沉淀Al3+可以控制溶液pH的范围为5~8 |
| C、向KAl(SO4)2溶液中加入KOH固体至pH=7时,c(K+):c(SO42-)=2:1 |
| D、往KAl(SO4)2溶液中加入足量的氢氧化钾溶液,反应的离子方程式可表示为:Al3++4OH-=AlO2-+2H2O |
有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,把它们溶于足量的水中,充分反应后,溶液中Ca2+、CO32-、HCO3-均转化为沉淀,将反应容器内水分蒸干,最后得白色固体物质共29g,则原混合物中含Na2CO3的质量是( )
| A、10.6 g |
| B、5.3 g |
| C、15.9 g |
| D、无法确定 |
BHT是一种常用食品抗氧化剂,合成方法有右边两种:下列说法正确的是( )


| A、甲与BHT均能与Na2CO3溶液反应,但后者有CO2生成,前者没有 |
| B、丙在浓硫酸和加热条件下可以转化为乙 |
| C、甲与BHT分子中所有碳原子共平面 |
| D、方法一和方法二的反应类型都是加成反应 |
下列离子方程式正确的是( )
| A、NH4HCO3溶液中加入少量稀NaOH溶液:NH4++OH-=NH3?H2O |
| B、FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| C、硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2=Fe3++2H2O |
| D、在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O=3H++2Br-+SO42- |

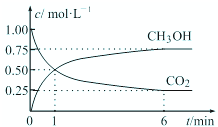 我国政府承诺,到2020年,单位GDP二氧化碳排放量比2005年下降40%~50%.
我国政府承诺,到2020年,单位GDP二氧化碳排放量比2005年下降40%~50%.