题目内容
 我国政府承诺,到2020年,单位GDP二氧化碳排放量比2005年下降40%~50%.
我国政府承诺,到2020年,单位GDP二氧化碳排放量比2005年下降40%~50%.(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
a.电解水制氢:2H2O
| ||
b.高温使水分解制氢:2H2O(g)
| ||
c.太阳光催化分解水制氢:2H2O
| ||
| 太阳光 |
d.天然气制氢:CH4+H2O(g)
| ||
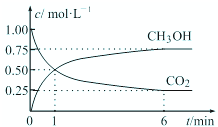
(2)CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)浓度随时间变化如图所示.
①从1min到6min,υ(H2)=
②能说明上述反应达到平衡状态的是
a.总压强保持不变
b.混合气体的密度不随时间的变化而变化
c.H2的体积分数在混合气体中保持不变
d.单位时间内消耗3mol H2,同时生成1mol H2O
e.反应中CO2与H2的物质的量之比为1:3保持不变
(3)工业上,也可用CO和H2在5MPa和250℃的条件下合成CH3OH.参考下表中合成反应CO(g)+2H2(g)?CH3OH(g)在不同温度下的平衡常数:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
a.该反应正反应是吸热反应,且△S<0
b.该反应达到平衡后,增大压强,CO的转化率升高
c.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,若达到平衡时CO转化率为50%,则此时的平衡常数为10
d.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下原料气转化率最高.
考点:化学平衡状态的判断,反应速率的定量表示方法,化学平衡的影响因素
专题:
分析:(1)用水分解或电解都要消耗能源,天然气也是有限资源,只有太阳能是取之不尽用之不竭的能源;
(2)①v=
计算反应速率;
②化学反应达到平衡状态时正逆反应速率相等,各物质的浓度不变,由此衍生的物理量不变;
3)A、由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,升高温度平衡向吸热反应移动;
B、增大压强平衡向气体体积减小的方向移动;
C、利用三段式计算出平衡时平衡混合物各组分的浓度,代入平衡常数的表达式计算;
D、由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,不利用原料气转化.
(2)①v=
| △c |
| t |
②化学反应达到平衡状态时正逆反应速率相等,各物质的浓度不变,由此衍生的物理量不变;
3)A、由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,升高温度平衡向吸热反应移动;
B、增大压强平衡向气体体积减小的方向移动;
C、利用三段式计算出平衡时平衡混合物各组分的浓度,代入平衡常数的表达式计算;
D、由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,不利用原料气转化.
解答:
解:(1)用水分解或电解都要消耗能源,天然气也是有限资源,只有太阳能是取之不尽用之不竭的能源,
A、消耗电能,不是最节能的方法,故A错误;
B、消耗热能,不是减碳的手段,故B错误;
C、利用太阳光催化分解水制氢是最节能的,故C正确;
D、天然气是非再生能源,且不是最节能的方法,故D错误;
故答案为:C;
(2)①从1min到6min,v(CO2)=
=
,则v(H2)=3v(CO2)=3×
=0.15mol/(L?min)-1,
故答案为:0.15;
②a.总压强保持不变,说明正逆反应速率相等,故正确;
b.混合气体的密度始终不变化,故错误
c.H2的体积分数在混合气体中保持不变,说明正逆反应速率相等,故正确;
d.单位时间内消耗3mol H2,同时生成1mol H2,未体现正逆的关系,故错误;
e.反应中CO2与H2的物质的量之比为1:3保持不变,从反应开始一直是这个比值,故错误;
故选:ac;
(3)A、由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,故A错误;
B、该反应达到平衡后,增大压强,平衡正向移动,CO的转化率升高,故B正确;
C、对于可逆反应:CO(g)+2H2(g)?CH3OH(g)
开始(mol/L):0.1 0.2 0
变化(mol/L):0.05 0.1 0.05
平衡(mol/L):0.05 0.1 0.05
所以平衡常数k=
=100,故C错误;
D、增大压强,平衡向正反应移动,有利于原料气转化.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,故升高不利用原料气转化,采取250℃温度,考虑反应速率与催化剂的活性,故D错误.
故选:B.
A、消耗电能,不是最节能的方法,故A错误;
B、消耗热能,不是减碳的手段,故B错误;
C、利用太阳光催化分解水制氢是最节能的,故C正确;
D、天然气是非再生能源,且不是最节能的方法,故D错误;
故答案为:C;
(2)①从1min到6min,v(CO2)=
| △c |
| t |
| 0.50mol/L-0.25mol/L |
| 6min-1min |
| 0.50mol/L-0.25mol/L |
| 6min-1min |
故答案为:0.15;
②a.总压强保持不变,说明正逆反应速率相等,故正确;
b.混合气体的密度始终不变化,故错误
c.H2的体积分数在混合气体中保持不变,说明正逆反应速率相等,故正确;
d.单位时间内消耗3mol H2,同时生成1mol H2,未体现正逆的关系,故错误;
e.反应中CO2与H2的物质的量之比为1:3保持不变,从反应开始一直是这个比值,故错误;
故选:ac;
(3)A、由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,故A错误;
B、该反应达到平衡后,增大压强,平衡正向移动,CO的转化率升高,故B正确;
C、对于可逆反应:CO(g)+2H2(g)?CH3OH(g)
开始(mol/L):0.1 0.2 0
变化(mol/L):0.05 0.1 0.05
平衡(mol/L):0.05 0.1 0.05
所以平衡常数k=
| 0.05 |
| 0.05×0.12 |
D、增大压强,平衡向正反应移动,有利于原料气转化.由表中数据可知,温度越高平衡常数越小,可逆反应向逆反应移动,故升高不利用原料气转化,采取250℃温度,考虑反应速率与催化剂的活性,故D错误.
故选:B.
点评:本题考查平衡状态的判断、平衡移动、平衡图象、反应速率计算、平衡常数、反应方向判断等,难度不大,注重基础知识的考查,注意基础知识的掌握.

练习册系列答案
相关题目
和水杨酸(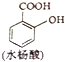 )分子式相同,并且分子中含有6个碳原子在一条直线上,分子中所有官能团包括水杨酸具有的含氧官能团的有机物是( )
)分子式相同,并且分子中含有6个碳原子在一条直线上,分子中所有官能团包括水杨酸具有的含氧官能团的有机物是( )
 )分子式相同,并且分子中含有6个碳原子在一条直线上,分子中所有官能团包括水杨酸具有的含氧官能团的有机物是( )
)分子式相同,并且分子中含有6个碳原子在一条直线上,分子中所有官能团包括水杨酸具有的含氧官能团的有机物是( )| A、2种 | B、3种 | C、4种 | D、5种 |
在配制500ml 0.1mol/L的H2SO4溶液时,下列操作中会导致结果偏高的是( )
| A、洗净的容量瓶未经干燥就用于配制溶液 |
| B、未等溶液降至室温就转移至容量瓶 |
| C、转移溶液时不慎洒到容量瓶外 |
| D、定容时仰视刻度线 |
常温下,下列各组离子在指定的溶液中能大量共存的是( )
| A、滴入酚酞显红色的溶液:Na+、Al3+、SO42-、Cl- | ||
| B、滴入KSCN显红色的溶液:Na+、Cu2+、Br-、SO42- | ||
C、
| ||
D、c(H+)=
|
今有五种有机物:其中既能发生加成反应、加聚反应、酯化反应,又能发生氧化反应的是( )
①CH2OH(CHOH)4CHO ②CH3(CH2)3OH③CH2═CH-CH2OH ④CH2═CH-COOCH3⑤CH2═CH-COOH.
①CH2OH(CHOH)4CHO ②CH3(CH2)3OH③CH2═CH-CH2OH ④CH2═CH-COOCH3⑤CH2═CH-COOH.
| A、③⑤ | B、①②⑤ | C、②④ | D、③④ |
已知酸性: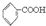 >H2CO3>
>H2CO3> >HCO3-将
>HCO3-将 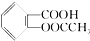 转变为
转变为 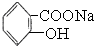 ,可行的方法是( )
,可行的方法是( )
 >H2CO3>
>H2CO3> >HCO3-将
>HCO3-将  转变为
转变为  ,可行的方法是( )
,可行的方法是( )| A、向该溶液中加入足量的稀硫酸,加热 |
| B、将该物质与稀硫酸共热后,再加入足量的NaOH溶液 |
| C、将该物质与足量的NaOH溶液共热,再通入足量CO2气体 |
| D、将该物质与稀硫酸共热后,再加入足量的NaHCO3溶液 |

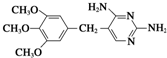 的副产物,为了使该产物的含量降到最低,需要合成路线中第
的副产物,为了使该产物的含量降到最低,需要合成路线中第 .化合物
.化合物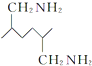 是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH