题目内容
某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下:
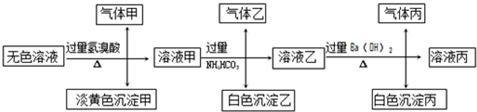
回答下列问题:
(1)生成沉淀甲的离子方程式: ;
(2)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
(3)由溶液甲生成沉淀乙的离子方程式: ;
(4)综上所述,该溶液中肯定存在的离子有: .
(5)针对溶液中可能存在的离子,用实验验证其是否存在的方法是 .

回答下列问题:
(1)生成沉淀甲的离子方程式:
(2)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | |||
| 2 | |||
| 3 | |||
| 4 |
(4)综上所述,该溶液中肯定存在的离子有:
(5)针对溶液中可能存在的离子,用实验验证其是否存在的方法是
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题,离子反应专题
分析:首先分析离子间的反应,如Ag+与题目所给的所有阴离子都能反应,不能大量共存,所以原溶液不含Ag+,由于气体甲为两种气体,则气体甲为二氧化碳和二氧化硫的混合物,所以溶液中一定存在CO32?和SO32-;由无色溶液加HBr产生淡黄色沉淀,则沉淀甲为S,则发生2S2-+SO32-+6H+=3S↓+3H2O,一定存在S2-、SO32-;溶液甲与过量碳酸氢铵反应,则沉淀乙为Al(OH)3,气体乙为二氧化碳,溶液乙中加过量氢氧化钡反应生成白色沉淀丙应为BaCO3,气体丙为氨气,然后结合离子的共存来分析.
解答:
解:(1)Ag+与题目所给的阴离子都能反应,不能大量共存,所以原溶液不含Ag+,所以淡黄色沉淀甲不是AgBr,为SO32?与S2?在酸性条件下反应生成的S单质沉淀,所以离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O,故答案为:2S2-+SO32-+6H+=3S↓+3H2O;
(2)气体甲由两种氧化物组成(不包括水蒸汽和HBr),因为氢溴酸为强酸,能与CO32?和SO32?反应生成CO2和SO2气体,所以气体甲含有的两种氧化物为SO2和CO2,首先利用SO2的漂白性,通入品红溶液检验SO2,为了防止SO2对CO2检验的干扰,第2步应利用SO2的还原性,通入酸性KMnO4除去SO2,然后再通入澄清石灰水,检验CO2的存在,
故答案为:
(3)因为Ba2+、Al3+不能与CO32?、SO32?共存,所以加入NH4HCO3后产生白色沉淀,说明原溶液含有AlO2-,加入过量氢溴酸后,转化为Al3+,Al3+与HCO3?反应生成Al(OH)3沉淀,离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)根据(1)可推出原溶液含有S2?、SO32?、CO32?;根据(2)可推出原溶液含有AlO2-;Ag+、Ba2+、Al3+与SO32?、CO32?等离子不能大量共存,根据溶液呈中性,所以原溶液还一定含有Na+,所以溶液中一定存在的离子为:S2-、SO32-、AlO2-、Na+、CO32-,故答案为:S2-、SO32-、AlO2-、Na+、CO32-;
(5)原溶液中有可能有硫酸根离子,溶液乙中含碳酸氢根离子,则沉淀丙为BaCO3,可能有BaSO4,在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3 外还有BaSO4;若全部溶解,则仅有BaCO3,
故答案为:取沉淀丙加入足量稀盐酸,若沉淀不能完全溶解,则原溶液中含SO42-,沉淀全部溶解,则原溶液中无SO42-.
(2)气体甲由两种氧化物组成(不包括水蒸汽和HBr),因为氢溴酸为强酸,能与CO32?和SO32?反应生成CO2和SO2气体,所以气体甲含有的两种氧化物为SO2和CO2,首先利用SO2的漂白性,通入品红溶液检验SO2,为了防止SO2对CO2检验的干扰,第2步应利用SO2的还原性,通入酸性KMnO4除去SO2,然后再通入澄清石灰水,检验CO2的存在,
故答案为:
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | 检验SO2 | 品红溶液 | 红色褪去 |
| 2 | 除尽SO2 | 酸性高锰酸钾溶液 | 紫色变浅或不完全褪去 |
| 3 | 检验CO2 | 澄清石灰水 | 变浑浊 |
(4)根据(1)可推出原溶液含有S2?、SO32?、CO32?;根据(2)可推出原溶液含有AlO2-;Ag+、Ba2+、Al3+与SO32?、CO32?等离子不能大量共存,根据溶液呈中性,所以原溶液还一定含有Na+,所以溶液中一定存在的离子为:S2-、SO32-、AlO2-、Na+、CO32-,故答案为:S2-、SO32-、AlO2-、Na+、CO32-;
(5)原溶液中有可能有硫酸根离子,溶液乙中含碳酸氢根离子,则沉淀丙为BaCO3,可能有BaSO4,在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3 外还有BaSO4;若全部溶解,则仅有BaCO3,
故答案为:取沉淀丙加入足量稀盐酸,若沉淀不能完全溶解,则原溶液中含SO42-,沉淀全部溶解,则原溶液中无SO42-.
点评:本题主要考查的是离子的共存及离子反应,利用流程及离子之间的反应推断出存在离子是解答的关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式表达正确的是( )
| A、向氯化铁溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2 |
| B、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20H-+5NO3-=3Fe2++3Fe3++5NO↑+10H2O |
在反应3NO2+H2O═2HNO3+NO中,发生还原反应和发生氧化反应的物质质量之比为( )
| A、3:1 | B、1:3 |
| C、1:2 | D、2:1 |
下列说法不正确的是( )
A、有机物B与 (M1=142.5)互为相邻同系物,则M(B)可能为128.5 (M1=142.5)互为相邻同系物,则M(B)可能为128.5 |
B、最简单的醛糖是甘油醛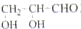 |
| C、苯和苯甲酸的混合物1mol,完全燃烧消耗O2的分子数为7.5NA |
| D、乙苯能被酸性KMnO4溶液氧化,是因为苯环对侧链上的-CH2-产生了影响,使其变活泼 |
如图所示的装置最适宜于干燥、收集的气体是( )


| A、NO |
| B、HC1 |
| C、NO2 |
| D、NH3 |
 如图所示,在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清. 四座工厂排出的废水里含有的污染物分别为:
如图所示,在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清. 四座工厂排出的废水里含有的污染物分别为: .
. 所示,
所示,