题目内容
20.下列热化学方程式中的反应热下划线处表示燃烧热的是( )| A. | 4NH3(g)+5O2(g)═4 NO(g)+6 H2O(g)△H=+a kJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H=-b kJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g)△H=-c kJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(g)△H=-d kJ•mol-1 |
分析 1mol纯物质燃烧生成稳定氧化物时放出的热量为燃烧热,结合物质的状态、常见的稳定氧化物判断燃烧热,以此来解答.
解答 解:A.NO、气态水不是稳定氧化物,且焓变为正,不是燃烧热,故A不选;
B.燃烧生成二氧化碳及液态水为稳定氧化物,且1mol葡萄糖燃烧,为燃烧热,故B选;
C.CO不是1mol,不是燃烧热,故C不选;
D.1molCH3CH2OH燃烧应生成二氧化碳和液态水时为燃烧热,故D不选;
故选B.
点评 本题考查热化学方程式,为高频考点,把握燃烧热的判断、反应中能量变化为解答的关键,侧重分析与应用能力的考查,注意稳定氧化物的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.在由水电离产生的H+的浓度为1×10-13mol/L的溶液中,离子组①K+、Cl-、SO32-、NO3-②Na+、Fe2+、I-、SO42-
③K+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3-⑤k+、Ba2+、Cl-、NO3-中一定能大量共存的组是( )
③K+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3-⑤k+、Ba2+、Cl-、NO3-中一定能大量共存的组是( )
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
15.有关电化学说法错误的是( )
| A. | 1 mol H2和0.5 mol O2反应放出的热量就是H2的燃烧热 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,相同条件下,前者放出的热量多 | |
| C. | 水中的钢闸门连接电源的负极,属于外加电流的阴极保护法 | |
| D. | 铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 |
5.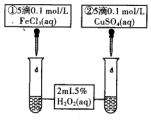 取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响.
取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响.
(1)实验1、2研究的是温度对H2O2分解速率的影响;实验3、4研究的是催化剂对H2 O2分解速率的影响.
(2)实验中可以判断该反应速率快慢的现象是产生气泡的快慢.
(3)有同学认为,若把实验3中的催化剂改成CuSO4进行如图操作,看到反应速率为①>②,一定可以说明Fe3+比Cu对H2O2分解催化效果好.你认为此同学的结论是否正确?不正确(填“正确”或“不正确”),理由是因为实验可能受到阴离子的干扰.
 取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响.
取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响.| 序号 | 条件 | |
| 温度/℃ | 催化剂 | |
| 1 | 40 | FeCl3溶液 |
| 2 | 20 | FeCl3溶液 |
| 3 | 20 | MnO2 |
| 4 | 20 | 无 |
(2)实验中可以判断该反应速率快慢的现象是产生气泡的快慢.
(3)有同学认为,若把实验3中的催化剂改成CuSO4进行如图操作,看到反应速率为①>②,一定可以说明Fe3+比Cu对H2O2分解催化效果好.你认为此同学的结论是否正确?不正确(填“正确”或“不正确”),理由是因为实验可能受到阴离子的干扰.
12.下列有关说法正确的是( )
| A. | 铁在熔融状态下能导电,所以铁是电解质 | |
| B. | 氯化氢在熔融状态下不导电,所以氯化氢是非电解质 | |
| C. | 氯气的水溶液能导电,所以氯气是电解质 | |
| D. | 电解质和非电解质都是纯净物 |
9.非金属性最弱的元素是( )
| A. | C | B. | Si | C. | S | D. | Cl |
10.下列图象分别表示有关反应的反应过程与能量变化的关系,下列说法中正确的是( )
| A. |  石墨转变为金刚石是吸热反应 | B. |  相同条件下等质量S(g)比S(s)的能量低 | ||
| C. |  白磷比红磷稳定 | D. |  CO(g)+H2O(g)═CO2(g)+H2(g)是吸热反应 |
 2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )