题目内容
反应4A(s)+3B(g)  2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.8 mol·L-1·s-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是相同的
 (1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0.CO和H2O浓度变化如图,则0〜4min的平均反应速率v(CO)= 0.03 mol/(L•min)
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0.CO和H2O浓度变化如图,则0〜4min的平均反应速率v(CO)= 0.03 mol/(L•min)(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3〜4min之间反应处于平衡状态;c3数值小于0.12mol/L(填大于、小于或等于).
②反应在4〜5min间,平衡向逆方向移动,可能的原因是b(单选),表中5〜6min之间数值发生变化,可能的原因是a(单选).
a.增加了水蒸气的量 b.升高温度 c.使用催化剂 d.增加压强
(3)如图是一个电化学的装置图.

①图中乙池是电解池装置(填“电解池”或“原电池”)甲池中OH-移向CH3OH极(填“CH3OH”或“O2”).若丙池中为400mL 1mol/L硫酸铜溶液,当外电路有1mol电子通过时,C、D两极共产生0.35mol的气体.
②写出B电极的电极反应式:Ag++e-=Ag.
Ⅰ.已知:Na2S2O3+H2SO4==Na2SO4+SO2↑+S ↓+H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
↓+H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度 | Na2S2O3浓度[ | 稀硫酸 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)该实验①、②可探究 对反应速率的影响,因此V1、V2和V3分别是 、 、 。
(2)实验①、③可探究 对反应速率的影响,因此V4、V5分别是 、 。
Ⅱ.二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。如图中的曲线表示二氧化氮分解反应在前25秒内的反应进程。
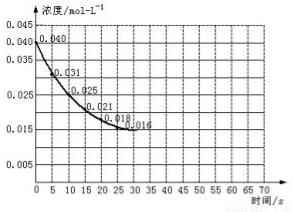
(3)前20秒内氧气的平均生成速率 mol/(L·s)
(4)在某温度下达到平衡时的平衡常数表达式是 。
(5)在某温度下达到平衡后,不改变其它条件,向该容器中再加入少量的NO2,平衡移动的方向是 ,NO2的平衡转化率 68.75%(填“>”、“<”或“=”),NO的体积百分含量 (填“增大”、“减小”或“不变”)。
(6)若在反应开始时加入催化剂(其他条件都不变),反应经过20秒达到平衡,请在图上用虚线画出加催化剂后反应0~70s的曲线。
| A. | 4NH3(g)+5O2(g)═4 NO(g)+6 H2O(g)△H=+a kJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H=-b kJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g)△H=-c kJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(g)△H=-d kJ•mol-1 |



 2c(g) ΔH1<0
2c(g) ΔH1<0