题目内容
8.在由水电离产生的H+的浓度为1×10-13mol/L的溶液中,离子组①K+、Cl-、SO32-、NO3-②Na+、Fe2+、I-、SO42-③K+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3-⑤k+、Ba2+、Cl-、NO3-中一定能大量共存的组是( )
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
分析 在由水电离产生的H+的浓度为1×10-13mol/L的溶液中存在大量氢离子或氢氧根离子,
①硝酸根离子在酸性条件下能够氧化亚硫酸根离子;
②亚铁离子与氢氧根离子反应;
③四种离子之间不反应,都不与氢离子、氢氧根离子反应;
④碳酸氢根离子与氢离子、氢氧根离子反应;
⑤四种离子之间不反应,都不与氢离子和氢氧根离子反应.
解答 解:在由水电离产生的H+的浓度为1×10-13mol/L的溶液呈酸性或碱性,溶液中中存在大量氢离子或氢氧根离子,
①SO32-、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故①错误;
②Fe2+与氢氧根离子反应,在碱性溶液中不能大量共存,故②错误;
③K+、Cl-、NO3-、SO42-之间不反应,都不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故③正确;
④HCO3-与氢离子和氢氧根离子反应,在溶液中不能大量共存,故④错误;
⑤K+、Ba2+、Cl-、NO3-之间不反应,都不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故⑤正确;
故选B.
点评 本题考查离子共存的判断,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
3.某物质中可能有甲酸、乙酸、甲醇和甲酸乙酯1种物质中1种或几种,在鉴别时有下列现象:(1)有银镜反应;(2)加入新制Cu(OH)2悬浊液沉淀不溶解;(3)与含酚酞的NaOH溶液共热发现溶液中红色逐渐消失以至无色,下列叙述正确的有( )
| A. | 几种物质都有 | B. | 有甲酸乙酯,可能有甲酸 | ||
| C. | 有甲酸乙酯和甲醇 | D. | 有甲酸乙酯,可能有甲醇 |
13.运用化学反应原理研究合成氨反应有重要意义,请完成下列探究.
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ•mol-1,△S=+133.7J•mol-1•K-1,
①该反应在低温下不能(填“能”或“不能”)自发进行.
②写出该反应的平衡常数表达式k=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)已知在400℃时,N2(g)+3H2(g)?2NH3(g)的K=0.5.
①在400℃时,2NH3(g)?N2(g)+3H2(g)的K′=2(填数值).
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正= v(N2)逆(填“>”、“<”、“=”或“不能确定”).
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡向左移动(填“向左”、“向左”或“不”);使用催化剂,反应的△H不改变(填“增大”、“减小”或“不改变”).
(3)水煤气转化反应CO(g)+H2O(g)?CO2(g)+H2(g)在一定温度下达到化学平衡.现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组教据:
①实验l中以CO2表示的反应速率为v(CO2)=0.16mol/(L•min);
②实验1的平衡常数K1大于实验2的平衡常数K2 (填“大于””小于,“等于”“不能确定”).
③该反应正方向为放 (填“吸”或‘放”)热反应.
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ•mol-1,△S=+133.7J•mol-1•K-1,
①该反应在低温下不能(填“能”或“不能”)自发进行.
②写出该反应的平衡常数表达式k=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)已知在400℃时,N2(g)+3H2(g)?2NH3(g)的K=0.5.
①在400℃时,2NH3(g)?N2(g)+3H2(g)的K′=2(填数值).
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正= v(N2)逆(填“>”、“<”、“=”或“不能确定”).
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡向左移动(填“向左”、“向左”或“不”);使用催化剂,反应的△H不改变(填“增大”、“减小”或“不改变”).
(3)水煤气转化反应CO(g)+H2O(g)?CO2(g)+H2(g)在一定温度下达到化学平衡.现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如表两组教据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
②实验1的平衡常数K1大于实验2的平衡常数K2 (填“大于””小于,“等于”“不能确定”).
③该反应正方向为放 (填“吸”或‘放”)热反应.
20.下列热化学方程式中的反应热下划线处表示燃烧热的是( )
| A. | 4NH3(g)+5O2(g)═4 NO(g)+6 H2O(g)△H=+a kJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H=-b kJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g)△H=-c kJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(g)△H=-d kJ•mol-1 |
17.下列变化中,属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓H2SO4稀释 ④KClO3分解制O2 ⑤生石灰跟水反应生成熟石灰⑥CaCO3高温分解 ⑦CO2+C═2CO ⑧Ba(OH)2•8H2O与固体NH4Cl混合 ⑨C+H2O(g)═CO+H2 ⑩Al与HCl反应.
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓H2SO4稀释 ④KClO3分解制O2 ⑤生石灰跟水反应生成熟石灰⑥CaCO3高温分解 ⑦CO2+C═2CO ⑧Ba(OH)2•8H2O与固体NH4Cl混合 ⑨C+H2O(g)═CO+H2 ⑩Al与HCl反应.
| A. | ①②④⑥⑦⑧⑨ | B. | ②④⑥⑦⑧⑨ | C. | ①④⑥⑧ | D. | ①②④⑧⑨ |
18.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,下列说法正确的是( )
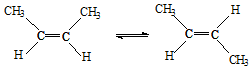 △H=-4.2kJ/mol.
△H=-4.2kJ/mol.
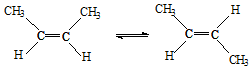 △H=-4.2kJ/mol.
△H=-4.2kJ/mol.| A. | 反-2-丁烯和顺-2-丁烯具有相同的熔沸点 | |
| B. | 顺-2-丁烯比反-2-丁烯更稳定 | |
| C. | 加压和降温有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯和顺-2-丁烯的核磁共振氢谱都有两个峰 |
