题目内容
3.下列关于氯的说法正确的是( )| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | Cl-、Cl为不同的核素,有不同的化学性质 | |
| C. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| D. | 电解饱和食盐水制氯气时,与电源负极相连的石墨棒上方充满黄绿色气体 |
分析 A.氯气既具有氧化性,也具有还原性;
B.根据核素的定义判断;
C.氯气不溶于饱和食盐水;
D.电解饱和食盐水制氯气时,与电源负极相连的石墨棒上生成氢气.
解答 解:A.氯气既具有氧化性,也具有还原性,如水、氢氧化钠等反应时,氯气既具有氧化性也表现了还原性,故A错误;
B.如中子数相同,则为同一核素,但核素只原子,而Cl-为离子,故B错误;
C.氯气不溶于饱和食盐水,可用排饱和食盐水集气法收集,故C正确;
D.电解饱和食盐水制氯气时,与电源负极相连的石墨棒上生成氢气,氯气在阳极生成,故D错误.
故选C.
点评 本题考查物质的性质,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,注意把握氯气的性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.如表为元素周期表的短周期部分.
请参照元素a-g在表中的位置,根据判断出的元素回答问题:
(1)比较d、e元素常见离子的半径大小(用化学式表示)O2->Na+;
(2)b、c两元素非金属性较强的是(写元素符号)N,写出证明这一结论的一个化学方程式2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O.
(3)d、e元素形成的四原子化合物的电子式为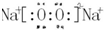 ;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”)
;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”)
| a | |||||||
| b | c | d | |||||
| e | f | g |
(1)比较d、e元素常见离子的半径大小(用化学式表示)O2->Na+;
(2)b、c两元素非金属性较强的是(写元素符号)N,写出证明这一结论的一个化学方程式2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O.
(3)d、e元素形成的四原子化合物的电子式为
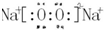 ;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”)
;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”)
14.通过传感器可以监测空气中甲醛的含量.一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是( )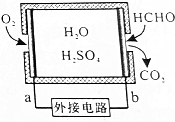

| A. | b为电池负极,甲醛被氧化 | |
| B. | a极的电极反应为O2+4e-+4H+=2H2O | |
| C. | 传感器工作过程中,电解质溶液中硫酸的浓度不变 | |
| D. | 当电路中转移1×10-4mol电子时,传感器内参加反应的HCHO为0.75mg |
8.下列离子方程式正确的是( )
| A. | 稀硫酸滴在银片上:2Ag+2H+═2Ag++H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 硝酸银溶液与盐酸反应:Ag++Cl-═AgCl↓ | |
| D. | 澄清石灰水与碳酸钠溶液反应:Ca(OH)2+CO32-═CaCO3↓+2OH- |
12.能影响水的电离平衡,最终使水电离的离子在溶液中表现为c(OH-)<c(H+)的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中通入二氧化碳气体 | D. | 向水中加醋酸钠晶体 |
13.A、B、C三种强电解质,它们在水中电离出的离子如表所示
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中C电极质量增加了54克.常温下各烧杯中溶液的pH与电解时间t的关系图如下.据此回答下列问题
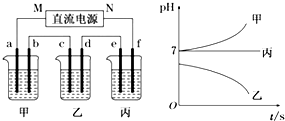
(1)N为电源的正极
(2)计算电极f上生成的气体在标准状况下的体积2.8L.
(3)写出乙烧杯中发生反应的化学方程式4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3.
(4)若电解后甲溶液的体积为5 L,则该溶液的pH为13.
(5)要使丙恢复到原来的状态,应加入4.5 gH2O.(填写化学式)
| 阳离子 | Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |

(1)N为电源的正极
(2)计算电极f上生成的气体在标准状况下的体积2.8L.
(3)写出乙烧杯中发生反应的化学方程式4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3.
(4)若电解后甲溶液的体积为5 L,则该溶液的pH为13.
(5)要使丙恢复到原来的状态,应加入4.5 gH2O.(填写化学式)