题目内容
8.化学与生活密切相关,下列叙述正确的是( )| A. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| B. | 点燃爆竹后,硫燃烧生产SO3 | |
| C. | 海水中含有溴元素,只进行物理变化就可以得到溴单质 | |
| D. | “地沟油”禁止使用,但可以用来制取肥皂 |
分析 A.二氧化硅是光导纤维主要成分,硅是制造太阳能电池原料;
B.硫燃烧生成二氧化硫;
C.可从化合价的变化判断;
D..“地沟油”主要成分是油脂.
解答 解:A.光纤通信使用的光缆主要成分是二氧化硅,太阳能电池使用的材料主要是Si,故A错误;
B.点燃爆竹后,硫燃烧生产SO2,故B错误;
C.海水中含有的溴元素是以Br-的形式存在,要转化为溴单质,元素必然降价,要发生还原反应,即只经过物理变化不能从海水中得到溴单质,故C错误;
D..“地沟油”禁止食用,但其主要成分是油脂,在碱性溶液中发生水解反应,又称皂化反应,可用于制取肥皂,故D正确;
故选D.
点评 本题考查了元素化合物知识,明确硅及二氧化硅的性质及用途,海水提溴的过程、地沟油的成分及性质是解题关键,题目难度不大.

练习册系列答案
相关题目
14.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前>N后 |
16.绿柱石被国际珠宝界公认为四大名贵宝石之一.主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿.试回答下列问题:
(1)基态Al原子中,电子填充的最高能级是3p,基态Cr原子的价电子排布式是3d54s1.
(2)用“>”或“<”填空:
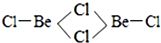
(3)BeCl2分子的空间构型是直线型,它的二聚体Be2Cl4结构如右图所示,其中Be原子的杂化方式是sp3.
(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式SiH4+2O2=SiO2+2H2O.
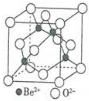
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg•cm-3,则晶胞连长为$\root{3}{\frac{100}{ρ{N}_{A}}}$cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示).
(1)基态Al原子中,电子填充的最高能级是3p,基态Cr原子的价电子排布式是3d54s1.
(2)用“>”或“<”填空:
| 第一电离能 | 键能 | 沸点 | 离子半径 |
| Be>B | C-C>Si-Si | H2S<H2O | Al3+<O2- |

(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式SiH4+2O2=SiO2+2H2O.
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg•cm-3,则晶胞连长为$\root{3}{\frac{100}{ρ{N}_{A}}}$cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示).

3.某药物中间体的合成路线如下.下列说法正确的是( )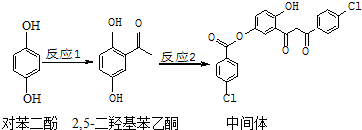

| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1mol该中间体最多可与11 molH2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
13.15g某金属混合物与足量盐酸完全反应,生成的氢气在标准状况下的体积为11.2L,则该混合物可能是( )
| A. | Mg、Al | B. | Mg、Fe | C. | Zn、Fe | D. | Al、Zn |
17.亚硝酸钠(NaNO2)是重要的防腐剂.某化学兴趣小组尝试制备亚硝酸钠,查阅资料:①HNO2为弱酸,在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成.
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如图1装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(反应方程式为2NO+Na2O2═2NaNO2,部分夹持装置和A中加热装置已略)

(1)写出装置A烧瓶中发生反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是B(填字母).
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
(3)第一组实验数据出现异常,造成这种异常的原因可能是A、C(填字母).
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(5)亚硝酸钠易溶于水,将0.2mol•L-1的亚硝酸钠溶液和0.1mol•L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为c(Na+)>c(NO2-)>c(Cl-)>c(H+)>c(OH-).
探究三 反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理.25℃时,反应进行10min,溶液的pH由7变为12.电化学降解NO3-的原理如图2所示.
(6)电源正极为A(填A或B),阴极反应式为2NO3-+6H2O+10e-=N2↑+12OH-.
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如图1装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(反应方程式为2NO+Na2O2═2NaNO2,部分夹持装置和A中加热装置已略)

(1)写出装置A烧瓶中发生反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是B(填字母).
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(5)亚硝酸钠易溶于水,将0.2mol•L-1的亚硝酸钠溶液和0.1mol•L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为c(Na+)>c(NO2-)>c(Cl-)>c(H+)>c(OH-).
探究三 反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理.25℃时,反应进行10min,溶液的pH由7变为12.电化学降解NO3-的原理如图2所示.
(6)电源正极为A(填A或B),阴极反应式为2NO3-+6H2O+10e-=N2↑+12OH-.
18.下列说法正确的是( )
| A. | 在标准状况下,1mol水和1molH2的 体积都约是22.4L | |
| B. | 2gH2和44gCO2的体积相等 | |
| C. | 1mol某气体的体积为22.4L,则该气 体一定处于标准状况 | |
| D. | 在标准状况下,1molH2和O2的混合气体体积约是22.4L |
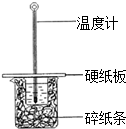 某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定
某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定