题目内容
20.下列装置或操作能达到实验目的是( )| A. | .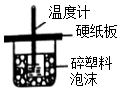 装置用于中和热的测定 | |
| B. | 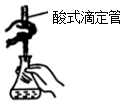 装置用于高锰酸钾溶液滴定草酸 | |
| C. | 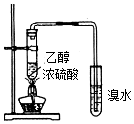 装置用于制取乙烯并验证乙烯的性质 | |
| D. | 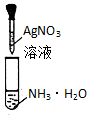 装置用于配制银氨溶液 |
分析 A.缺少环形玻璃棒;
B.高锰酸钾具有强氧化性,应盛装在酸式滴定管中;
C.应避免二氧化硫的干扰;
D.试剂的滴加顺序错误.
解答 解:A.测定中和热时,应用玻璃棒搅拌,以使反应迅速发生,题目缺少环形玻璃棒,故A错误;
B.高锰酸钾具有强氧化性,应盛装在酸式滴定管中,操作符合要求,故B正确;
C.浓硫酸与乙醇的反应,生成乙烯的同时生成二氧化硫,二氧化硫与溴水反应,应避免二氧化硫的干扰,故C错误;
D.制备银氨溶液,应在硝酸银溶液中滴加氨水至沉淀恰好溶解,避免氨水过量,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质制备、中和热的测定、滴定等,把握实验原理及实验装置的作用为解答的关键,注意实验操作的可行性、评价性分析,题目难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
10.维生素C(C6H8O6)主要存在于蔬菜和水果中,它能促进人体生长发育,增强人体对疾病的抵抗力.近年来,科学家发现维生素C有防癌作用.下列关于维生素C的说法中错误的是( )
| A. | 维生素C是氧化物 | |
| B. | 维生素C由6个碳元素、8个氢元素、6个氧元素组成 | |
| C. | 维生素C中C、H、O三种元素的质量比为9:1:12 | |
| D. | 青少年应多吃蔬菜水果,切忌偏食 |
11.室温下,A、B两烧杯均盛有10mlpH=2的HA酸溶液,向B烧杯中加水稀释至pH=3,关于A、B两烧杯中溶液的描述正确的是( )
| A. | 水电离出的OH-浓度:10c(OH-)A>c(OH-)B | |
| B. | 溶液的体积:10VA≤VB | |
| C. | 若分别用等浓度的氢氧化钠溶液完全中和,所得溶液的pH:A>B | |
| D. | 若分别与10mLpH=12的氢氧化钠溶液反应,所得溶液的pH:A≤B |
5.含有CO、N2、H2、CO2和少量水蒸气的混合气体,依次通过足量的灼热氧化铜、浓氢氧化钠溶液、浓硫酸后,剩余的气体是( )
| A. | N2 | B. | N2和H2 | C. | N2和CO2 | D. | H2和CO |
12.下列物质在水溶液中的电离方程式中,正确的是( )
| A. | H2SO4=H2++SO42- | B. | Na2CO3=Na++CO32- | ||
| C. | NaHSO4=Na++H++SO42- | D. | Ca(OH)2=Ca2++2(OH)- |
9.能证明SO2是酸性氧化物的是( )
| A. | 酸性KMnO4溶液中通入SO2气体后紫红色消失 | |
| B. | 滴有酚酞的NaOH溶液中通入SO2气体后红色消失 | |
| C. | 品红溶液中通入SO2气体后红色消失 | |
| D. | 溴水中通入SO2气体后橙色消失 |