题目内容
11.室温下,A、B两烧杯均盛有10mlpH=2的HA酸溶液,向B烧杯中加水稀释至pH=3,关于A、B两烧杯中溶液的描述正确的是( )| A. | 水电离出的OH-浓度:10c(OH-)A>c(OH-)B | |
| B. | 溶液的体积:10VA≤VB | |
| C. | 若分别用等浓度的氢氧化钠溶液完全中和,所得溶液的pH:A>B | |
| D. | 若分别与10mLpH=12的氢氧化钠溶液反应,所得溶液的pH:A≤B |
分析 A.两溶液都是酸溶液,酸溶液中的氢氧根离子是水电离的,根据水的离子积计算出水电离的氢氧根离子浓度;
B.如果酸为强酸,则10VA=VB,如果酸为弱酸,则10VA<VB;
C.如果生成的盐不水解,则两溶液的pH相等,如果生成的盐水解,溶液浓度越大,水解导致的碱性越强,则A烧杯中溶液的碱性大于B烧杯溶液的碱性;
D.如果酸是强酸,则恰好反应,溶液为中性;如果酸是弱酸,则酸过量,反应后的混合液显示酸性.
解答 解:A.pH=3的酸中,氢氧根离子全部有水电离产生,C(OH-)B=$\frac{Kw}{C(H{\;}^{+})}$=10-11mol/L,pH=2的酸中,氢氧根离子全部有水电离产生,C(OH-)A=$\frac{Kw}{C(H{\;}^{+})}$=10-12mol/L,则10c(OH-)A=c(OH-)B,故A错误;
B.若酸强酸,则依据溶液吸稀释过程中氢离子物质的量不变10ml×10-2=V×10-3,解得V=100ml,则10VA=VB,若酸为弱酸,加水稀释时,促进弱酸的电离,电离产生的氢离子增多,要使pH仍然为3,加入的水应该多一些,则10VA<VB,所以溶液的体积:10VA≤VB,故B正确;
C.稀释前后甲乙两个烧杯中所含的一元酸的物质的量相等,依据酸碱中和反应可知,消耗氢氧化钠的物质的量相等,生成的酸盐的浓度A大于B,若酸为强酸则二者pH相等,若酸为弱酸,则A的pH大于B,故C错误;
D.若酸是强酸,分别与10mL pH=12的NaOH溶液反应,恰好发生酸碱中和,生成强酸强碱盐,pH值相等,若为弱酸,则反应后酸有剩余,A中剩余酸浓度大,酸性强,pH小,所得溶液的pH:A≤B,故D正确;
故选:BD.
点评 本题考查了弱电解质的电离,酸碱中和的实质,pH的相关计算,题目难度中等,准确理解题意,抓住弱酸存在电离平衡的特点解答.

 通城学典默写能手系列答案
通城学典默写能手系列答案| A. | 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y | |
| B. | 卤族元素的最高正化合价等于其主族序数 | |
| C. | 元素周期表中从ⅢB族到ⅡB族十个纵列的元素都是金属元素 | |
| D. | Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 |
| A. | 氧化性:Fe3+>Cu2+>Fe2+>Zn2+ | B. | 还原性:Fe3+>Cu2+>Fe2+>Zn2+ | ||
| C. | 氧化性:Zn>Fe>Cu>Fe2+ | D. | 还原性:Zn>Fe>Cu>Fe2+ |
| A. | C和E的单质常温下不能相互反应 | |
| B. | C与B形成的两种化合物均属于离子化合物,且化学键类型完全相同 | |
| C. | 原子半径:C>D>A>B | |
| D. | A、D、E的最高价氧化物对应水化物均为弱酸 |
| A. | . 装置用于中和热的测定 | |
| B. |  装置用于高锰酸钾溶液滴定草酸 | |
| C. |  装置用于制取乙烯并验证乙烯的性质 | |
| D. |  装置用于配制银氨溶液 |
| A. | 面心立方最密堆积 | B. | 体心立方最密堆积 | ||
| C. | 六方最密堆积 | D. | 简单立方堆积 |

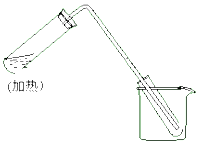 如图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中实验完全相同.回答下列问题: