题目内容
12.下列物质在水溶液中的电离方程式中,正确的是( )| A. | H2SO4=H2++SO42- | B. | Na2CO3=Na++CO32- | ||
| C. | NaHSO4=Na++H++SO42- | D. | Ca(OH)2=Ca2++2(OH)- |
分析 A.硫酸为二元强酸,一步完全电离,氢离子下标应为计量数,书写错误;
B.电离方程式左右电荷不守恒;
C.NaHSO4是强酸强碱酸式盐,属强电解质,溶液中完全电离,电离出Na+、H+、SO42-离子;
D.氢氧化钙完全电离出钙离子和氢氧根离子,氢氧根离子书写错误.
解答 解:A.硫酸为二元强酸,完全一步电离出氢离子和硫酸根离子,电离方程式为:H2SO4=2H++SO42-,故A错误;
B.碳酸钠是盐,为强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,故B错误;
C.硫酸氢钠属于二元强酸硫酸的酸式盐,能完全电离:NaHSO4=Na++H++SO42-,故C正确;
D.Ca(OH)2是二元强碱,为强电解质,完全电离,电离方程式:Ca(OH)2=Ca2++2OH-,故D错误;
故选C.
点评 本题考查电解质的电离方程式书写,题目难度不大,掌握电离方程式书写规则并能灵活运用是正确解答此类题的关键.化学式和离子符号表示电离过程的式子,称为电离方程式,电离方程式书写:1、先判断物质类型及电离出的阴阳离子;2、确定用可逆号还是等号;3、确定电离出的离子,4、要注意原子守恒、电荷守恒.

练习册系列答案
相关题目
2.已知:Fe+Cu2+=Fe2++Cu,Zn+Fe2+=Zn2++Fe,2Fe3++Cu=2Fe2++Cu2+,下列判断正确的是( )
| A. | 氧化性:Fe3+>Cu2+>Fe2+>Zn2+ | B. | 还原性:Fe3+>Cu2+>Fe2+>Zn2+ | ||
| C. | 氧化性:Zn>Fe>Cu>Fe2+ | D. | 还原性:Zn>Fe>Cu>Fe2+ |
20.下列装置或操作能达到实验目的是( )
| A. | .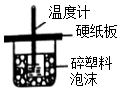 装置用于中和热的测定 | |
| B. | 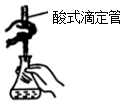 装置用于高锰酸钾溶液滴定草酸 | |
| C. | 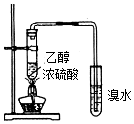 装置用于制取乙烯并验证乙烯的性质 | |
| D. | 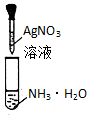 装置用于配制银氨溶液 |
7.下列反应的离子方程式书写正确的是( )
| A. | 钠和水反应2Na+H2O═2Na++OH-+H2↑ | |
| B. | 氯化镁溶液加入氨水:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 氯气与水反应:Cl2+H2O?H++Cl-+HClO | |
| D. | 氢氧化钡与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
17.在强酸性溶液中,下列离子组能大量共存且溶液无色透明的是( )
| A. | Ag+、Na+、Cl-、K+ | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
1.下列选项中不是常见的等径圆球堆积方式的是( )
| A. | 面心立方最密堆积 | B. | 体心立方最密堆积 | ||
| C. | 六方最密堆积 | D. | 简单立方堆积 |
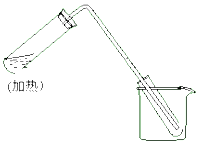 如图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略),其原理与教材中实验完全相同.回答下列问题:
 +nCH3OH$→_{△}^{浓H_{2}SO_{4}}$
+nCH3OH$→_{△}^{浓H_{2}SO_{4}}$ +2nH2O.
+2nH2O. +2nCH3OH.
+2nCH3OH.