题目内容
为分析某县城的空气质量情况,某校化学研究性学习小组的同学拟测定该县城空气中SO2的含量.
(1)检验SO2可选用 试液.
(2)SO2与酸性KMnO4溶液反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.该反应的现象是 ,SO2在该反应中显 (填“氧化”或“还原”)性.
(3)该小组的同学拟用下列装置运用“(2)”中的反应原理定量分析空气中SO2的含量:

①装置中棉花的作用是 ,通入空气前应进行的实验操作是 ;
②该实验中需要知道的数据除气体流速、酸性KMnO4溶液的体积外还有 .
(1)检验SO2可选用
(2)SO2与酸性KMnO4溶液反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.该反应的现象是
(3)该小组的同学拟用下列装置运用“(2)”中的反应原理定量分析空气中SO2的含量:

①装置中棉花的作用是
②该实验中需要知道的数据除气体流速、酸性KMnO4溶液的体积外还有
考点:探究物质的组成或测量物质的含量,二氧化硫的化学性质
专题:氧族元素
分析:(1)二氧化硫使品红试液褪色;
(2)高锰酸根离子被还原,形成无色的二价锰离子;SO2中S元素化合价升高,显还原性;
(3)①装置中棉花可以防止固体颗粒进入KMnO4溶液;有气体参与的体系应先进行气密性检验;
②根据单位时间内消耗的高锰酸钾的量计算,知道酸性KMnO4溶液的体积外还需要酸性KMnO4溶液的浓度.
(2)高锰酸根离子被还原,形成无色的二价锰离子;SO2中S元素化合价升高,显还原性;
(3)①装置中棉花可以防止固体颗粒进入KMnO4溶液;有气体参与的体系应先进行气密性检验;
②根据单位时间内消耗的高锰酸钾的量计算,知道酸性KMnO4溶液的体积外还需要酸性KMnO4溶液的浓度.
解答:
(1)二氧化硫使品红试液褪色,检验二氧化硫可以使用品红试液;
故答案为:品红;
(2)高锰酸根离子被还原,生成无色的二价锰离子,紫色溶液褪色;SO2生成SO42-,化合价有+4价升高到+6价,被氧化,显还原性;
故答案为:紫色溶液褪色;还原;
(3)①装置中棉花可以防止固体颗粒进入KMnO4溶液;有气体参与的体系应先进行气密性检验;
故答案为:防止固体颗粒进入KMnO4溶液;检查装置的气密性;
②根据单位时间内消耗的高锰酸钾的量计算,知道酸性KMnO4溶液的体积外还需要酸性KMnO4溶液的浓度.
故答案为:酸性KMnO4溶液的浓度.
故答案为:品红;
(2)高锰酸根离子被还原,生成无色的二价锰离子,紫色溶液褪色;SO2生成SO42-,化合价有+4价升高到+6价,被氧化,显还原性;
故答案为:紫色溶液褪色;还原;
(3)①装置中棉花可以防止固体颗粒进入KMnO4溶液;有气体参与的体系应先进行气密性检验;
故答案为:防止固体颗粒进入KMnO4溶液;检查装置的气密性;
②根据单位时间内消耗的高锰酸钾的量计算,知道酸性KMnO4溶液的体积外还需要酸性KMnO4溶液的浓度.
故答案为:酸性KMnO4溶液的浓度.
点评:本题考查物质组成与含量的测定、对实验原理理解、阅读获取信息的能力等,难度不大,是对知识的综合运用,理解实验原理是解题的关键.

练习册系列答案
相关题目
根据下列化学方程式判断物质氧化性或还原性强弱排序正确的是( )
①2FeCl3+Cu=2FeCl2+CuCl2 ②CuCl2+Fe=FeCl2+Cu.
①2FeCl3+Cu=2FeCl2+CuCl2 ②CuCl2+Fe=FeCl2+Cu.
| A、还原性:Fe>Cu>FeCl2 |
| B、还原性:Fe>FeCl2>Cu |
| C、氧化性:CuCl2>FeCl3>FeCl2 |
| D、氧化性:FeCl3>FeCl2>CuCl2 |
如图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
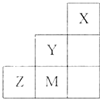

| A、气态氢化物稳定性为:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、ZM2分子中各原子的最外层均满足8电子稳定结构 |
| D、三种元素中,Y的非金属性最强,Y的最高价氧化物的水化物的酸性最强 |
下列说法正确的是( )
| A、氯碱工业中,阴极区只需加入水 |
| B、电解熔融氯化铝制取金属铝 |
| C、电镀时,用镀层金属作阳极 |
| D、将钢闸门与外电源正极相连,可防止其腐蚀 |
常温下,Ksp(CaCO3)=4.96×10-9,Ksp(MgCO3)=6.82×10-6.含有MgCO3沉淀的MgCl2溶液中,已知c(Mg2+)=0.2mol/L.如果加入等体积的CaCl2溶液,若要产生CaCO3沉淀,加入CaCl2溶液的物质的量浓度最小约为( )
| A、7.27×10-5mol/L |
| B、1.45×10-4mol/L |
| C、2.9×10-4mol/L |
| D、5.8×10-4mol/L |