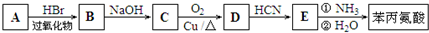题目内容
常温下,Ksp(CaCO3)=4.96×10-9,Ksp(MgCO3)=6.82×10-6.含有MgCO3沉淀的MgCl2溶液中,已知c(Mg2+)=0.2mol/L.如果加入等体积的CaCl2溶液,若要产生CaCO3沉淀,加入CaCl2溶液的物质的量浓度最小约为( )
| A、7.27×10-5mol/L |
| B、1.45×10-4mol/L |
| C、2.9×10-4mol/L |
| D、5.8×10-4mol/L |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:要生成沉淀,则应满足c(Ca2+)×c(CO32-)≥4.96×10-9根据溶度积计算浓度.
解答:
解:要生成沉淀,则应满足c(Ca2+)×c(CO32-)≥4.96×10-9,Ksp(MgCO3)=6.82×10-6,含有MgCO3沉淀的MgCl2溶液中,已知c(Mg2+)=0.2mol?L-1,则混合后MgCl2溶液中c(CO32-)≤3.41×10-5,
则c(CaCl2)=c(Ca2+)=
=
=1.45×10-4mol?L-1,则加入CaCl2溶液的物质的量浓度最小约为1.45×10-4mol?L-1,
故选B.
则c(CaCl2)=c(Ca2+)=
| Ksp(CaCO3) |
| c(CO32-) |
| 4.96×10-9 |
| 341×10-5 |
故选B.
点评:本题考查了沉淀的溶度积的计算,题目难度中等.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
为了防止热带鱼池中水藻的生长,需保持水中Cu2+的浓度约1.2×10-5mol?L-1.为避免在每次换池水时溶液浓度的改变,可把适当的含铜化合物放在池底,其饱和溶液提供适当的Cu2+.已知CuS、Cu(OH)2、CuCO3的Ksp值依次为1.3×10-36、2.2×10-20、1.4×10-10,下列四种物质中,能满足池水浓度要求的是( )
| A、CuS |
| B、Cu(NO3)2 |
| C、Cu(OH)2 |
| D、CuCO3 |
如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )
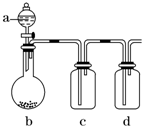

| A、若a为浓硫酸,b为Na2SO3固体,c中盛石蕊溶液,则c中溶液先变红后褪色 |
| B、若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液不褪色 |
| C、若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊 |
| D、若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 |
只用一种试剂就能鉴别AgNO3溶液、乙醇溶液、苯酚溶液、烧碱溶液、硫氰化钾溶液,该试剂是( )
| A、溴水 |
| B、盐酸 |
| C、石蕊 |
| D、FeCl3溶液 |
如图所示,两个连通容器用活塞分开,左室容积为右室的两倍,但温度相同,现分别按如图所示的量充入气体,加入少量固体催化剂使左右两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列有关判断正确的是( )
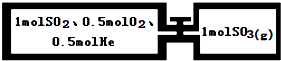

| A、通入气体未反应前,左室压强比右室大 |
| B、第一次平衡时,左室内压强一定小于右室 |
| C、第一次平衡时,SO2的物质的量右室更多 |
| D、第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍多 |
下列说法正确的是( )
| A、常温下,在0.1mol/LNaOH溶液和0.1mol/L盐酸中水的离子积相等 |
| B、常温下,在水中加入NaOH,水的电离受到抑制,水的离子积减小 |
| C、HCl溶液中无OH-,NaOH溶液中无H+,NaCl溶液中既无OH-也无H+ |
| D、在水溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |

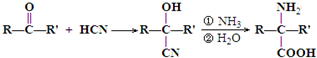
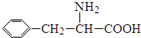 )是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
)是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示: