题目内容
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若1mol KNO3反应,则下列说法正确的是( )
| A、N2是还原产物 |
| B、KNO3被氧化 |
| C、转移电子的物质的量为5 mol |
| D、被氧化的N原子的物质的量为1 mol |
考点:氧化还原反应
专题:氧化还原反应专题
分析:10NaN3+2KNO3═K2O+5Na2O+16N2↑中,NaN3中N元素化合价升高,被氧化,KNO3中N元素化合价降低,被还原;2mol KNO3反应转移电子为2mol×(5-0)=10mol,以此来解答.
解答:
解:A.该反应中只有N元素的化合价变化,则氮气既是氧化产物也是还原产物,故A错误;
B.KNO3中N元素化合价降低,被还原,故B错误;
C.1mol KNO3反应,转移电子为1mol×(5-0)=5mol,故C正确;
D.由反应可知,2mol KNO3反应,有30molN原子被氧化,则1mol KNO3反应被氧化的N原子的物质的量为15 mol,故D错误;
故选C.
B.KNO3中N元素化合价降低,被还原,故B错误;
C.1mol KNO3反应,转移电子为1mol×(5-0)=5mol,故C正确;
D.由反应可知,2mol KNO3反应,有30molN原子被氧化,则1mol KNO3反应被氧化的N原子的物质的量为15 mol,故D错误;
故选C.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意将N3-作为整体来分析是解答的难点,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
设NA为阿伏伽德罗常数,下列说法错误的是( )
| A、在1L 2mol/L的硝酸溶液中含有的硝酸根离子数为4NA |
| B、标准状况下22.4L乙醇完全燃烧,生成的二氧化碳分子数为2NA |
| C、46g二氧化氮和46g四氧化二氮含有的原子数均为3NA |
| D、1mol氢氧根离子中含有的电子数为10NA |
关于下列四个图象的说法正确的是( )


| A、已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)中的c[Fe(SCN)2+]与温度T的平衡图象.A点与B点相比,A点的c(Fe3+)大 |
| B、图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V与时间t 的关系.则反应中镁和铝的反应速率之比为2:3 |
| C、图③表示电源X极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-=O2↑+2H2O |
| D、图④是某温度下,相同体积,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线.Ⅱ为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b |
将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
| A、c(Ac-)>c(Cl-)>c(H+)>c(HAc) |
| B、c(Na+)+c(H+)=c(Ac-)+c(Cl-) |
| C、c(Ac-)=c(Cl-)>c(H+)>c(HAc) |
| D、c(Ac-)>c(Cl-)>c(HAc)>c(H+) |
已知图①~④的相关信息,下列相应叙述正确的是( )
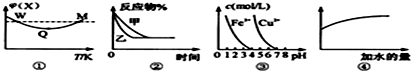

| A、图①表示向恒容密闭容器中充入X和Y发生反应:2X(g)+Y(g)?3Z(g)△H<0,W点X的正反应速率等于M点X的正反应速率 |
| B、图②表示压强对可逆反应A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强小 |
| C、据图③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至PH在4左右 |
| D、常温下,稀释0.1mol/L Na2CO3溶液,图④中的纵坐标可表示溶液中HCO3-的数目 |
下列说法正确的是( )
| A、焊锡(锡铅合金)熔点比金属锡高 |
| B、油脂的皂化反应生成脂肪酸和甘油 |
| C、焰火的五彩缤纷是某些金属元素的性质的展现 |
| D、NaFeO4自身处理水的原理与明矾和漂白粉共同处理水的原理不同 |
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,Z和Y组成原电池时,Z为电池的负极.X、Y、Z三种金属的活动性顺序为( )
| A、X>Y>Z |
| B、X>Z>Y |
| C、Y>X>Z |
| D、Y>Z>X |
反应A(g)+3B(g)?2C(g)△h<0,在其他条件不变的情况下,下列说法正确的是( )
| A、加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B、增大压强,平衡正向移动,平衡常数增大 |
| C、当反应达平衡时,气体的平均相对分子质量不变 |
| D、升高温度,反应速率加快,反应放出的热量值增大 |