题目内容
设NA为阿伏伽德罗常数,下列说法错误的是( )
| A、在1L 2mol/L的硝酸溶液中含有的硝酸根离子数为4NA |
| B、标准状况下22.4L乙醇完全燃烧,生成的二氧化碳分子数为2NA |
| C、46g二氧化氮和46g四氧化二氮含有的原子数均为3NA |
| D、1mol氢氧根离子中含有的电子数为10NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据n=CV=
计算;
B、标准状况,乙醇不是气体;
C、依据n=
计算物质的量,结合分子式计算原子数;
D、依据氢氧根离子所含电子数计算分析判断.
| N |
| NA |
B、标准状况,乙醇不是气体;
C、依据n=
| m |
| M |
D、依据氢氧根离子所含电子数计算分析判断.
解答:
解:A、依据n=CV=
计算溶液中硝酸溶质物质的量=1L×2mol/L=2mol,含有的硝酸根离子数为2NA,故A错误;
B、标准状况,乙醇不是气体,22.4L乙醇物质的量不是1mol,故B错误;
C、依据n=
计算物质的量,结合分子式计算原子数,46g二氧化氮物质的量=
=1mol,含有原子数3NA,46g四氧化二氮物质的量=
=0.5mol含有的原子数为0.5mol×6×NA=3NA,均为3NA,故C正确;
D、依据氢氧根离子所含电子数计算,1mol氢氧根离子中含有的电子数为10NA,故D正确;
故选AB.
| N |
| NA |
B、标准状况,乙醇不是气体,22.4L乙醇物质的量不是1mol,故B错误;
C、依据n=
| m |
| M |
| 46g |
| 46g/mol |
| 46g |
| 92g/mol |
D、依据氢氧根离子所含电子数计算,1mol氢氧根离子中含有的电子数为10NA,故D正确;
故选AB.
点评:本题考查了阿伏伽德罗常数的分析应用,气体摩尔体积的条件分析应用,溶液中离子浓度计算,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列有关物质水解的说法正确的是( )
| A、蛋白质水解的最终产物是多肽 |
| B、淀粉水解的最终产物是葡萄糖 |
| C、纤维素不能水解成葡萄糖 |
| D、油脂水解产物之一是甘油 |
己知:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25kJ?mol-1.某温度下的平衡常数为400.此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是( )
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol?L-1) | 0.08 | 1.6 | 1.6 |
| A、此时刻反应达到平衡状态 |
| B、容器内压强不变时,说明反应达平衡状态 |
| C、平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变 |
| D、平衡时,反应混合物的总能量降低40kJ |
下列有关物质的性质和该性质的应用均正确的是( )
| A、SiO2具有较好的导电性,可用于制造半导体材料 |
| B、H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹 |
在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2mol A和1mol B,发生反应如下:2A(g)+B(g)?2D(g)△H=-QKJ?mol-1.相关条件和数据见如表,下列说法正确的是( )
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| 达平衡时间/min | 40 | 10 | 30 |
| c(D)平衡/mol?L-1 | 0.5 | 0.5 | 0.15 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 |
| A、可用压强或密度是否发生变化判断上述反应是否达到平衡 |
| B、实验Ⅱ可能隐含的条件是使用催化剂,实验Ⅲ达平衡时υ(D)为0.01mol?L-1?min-1 |
| C、由表中信息可知Q>O,并显有Q3<Q2=Q1=Q |
| D、实验Ⅰ达平衡后,恒温下再向容器中通入1mol A和1mol D,达平衡时c(D)为1.0mol?L-1 |
金银花中能提取出有很高药用价值的绿原酸(如图),下列判断正确的是( )
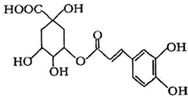

| A、分子中有可能所有碳原子共平面 |
| B、分子式为C16H18O9 |
| C、分子中含有醚键 |
| D、分子中有4个手性碳原子 |
形成物质世界多样性的原因有( )
①元素种类;②同位素;③成键方式;④同素异形现象;⑤反应现象.
①元素种类;②同位素;③成键方式;④同素异形现象;⑤反应现象.
| A、①③④⑤ | B、①②④⑤ |
| C、①②③④ | D、①②③④⑤ |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.若1mol KNO3反应,则下列说法正确的是( )
| A、N2是还原产物 |
| B、KNO3被氧化 |
| C、转移电子的物质的量为5 mol |
| D、被氧化的N原子的物质的量为1 mol |
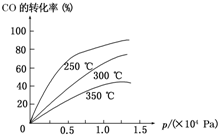 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇: