题目内容
20.用双线桥分析反应K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O,标出电子转移的方向和数目, ;反应中1mol氧化剂得到 (填“得到”或“失去”)6mol电子.
;反应中1mol氧化剂得到 (填“得到”或“失去”)6mol电子.
分析 K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O中,Cr元素的化合价降低,Cl元素的化合价升高,该反应转移6e-,以此来解答.
解答 解:氧化还原反应K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O中,化合价升高元素Cl失电子,化合价降低元素Cr得电子,得失电子数目相等=反应中转移电子数=6e-,双线桥表示电子转移为 ,由Cr元素的化合价变化可知反应中1mol氧化剂得到电子为1mol×2×(6-3)=6mol,
,由Cr元素的化合价变化可知反应中1mol氧化剂得到电子为1mol×2×(6-3)=6mol,
故答案为: ;得到;6.
;得到;6.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意常见元素的化合价判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列有关说法正确的是( )
| A. | NH4Cl(s)═NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反 | |
| C. | 对于N2(g)+3H2(g)?2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 | |
| D. | 25℃时NH3•H2O稀溶液中,加水稀释$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{H}_{4}^{+})}$的值增大 |
11.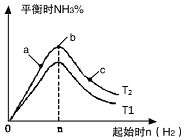 在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.
在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.
(1)若平衡后同种物质的体积分数相同,起始时乙容器通入的N2的物质的量为1.6mol,
起始时乙中的压强是甲容器的0.8倍,乙的平衡常数为107(mol/L)-2
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是bc(选填序号).
(3)研究在其他条件不变时,改变起始物氢气的物质的量对反应的影响,实验结果如图所示(图中T表示温度,n表示物质的量):
①像中T2和T1的关系是:T2低于T1(填“高于”“低于”“等于”“无法确定”).
②a、b、c三点中,N2转化率最高的是c(填字母).
③若容器容积为1L,T2℃在起始体系中加入1mol N2,3molH2,经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为0.24mol.L-1.min-1.保持容器体积不变,若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q>110.88kJ(填“>”、“<”或“=”).
 在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.
在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
| 乙 | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
起始时乙中的压强是甲容器的0.8倍,乙的平衡常数为107(mol/L)-2
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是bc(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
①像中T2和T1的关系是:T2低于T1(填“高于”“低于”“等于”“无法确定”).
②a、b、c三点中,N2转化率最高的是c(填字母).
③若容器容积为1L,T2℃在起始体系中加入1mol N2,3molH2,经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为0.24mol.L-1.min-1.保持容器体积不变,若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q>110.88kJ(填“>”、“<”或“=”).
8.下列热化学方程式正确的是(注:AH的绝对值均正确)( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g);△H=+269.8kJ/mol(反应热) | |
| D. | 2HCl(g)═Cl2(g)+H2(g);△H=-184.6kJ/mol(反应热) |
15.下列说法不正确的是( )
| A. | 盐的组成中不一定含有金属元素 | |
| B. | 强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强 | |
| C. | 同种元素在不同的化合物中的化合价不一定相同 | |
| D. | 由同种元素组成的物质一定是单质 |
5.想一想:Ba(OH)2(固体)、铜、水(液体)这些物质为什么能归为一类,下列物质中还可以与它们归为一类的是( )
| A. | 75%酒精 | B. | 氢氧化铁胶体 | C. | 硝酸钠 | D. | 粗盐 |
12.下列实验操作正确的是( )
| A. |  | B. |  | ||
| C. |  检查容量瓶是否漏水 | D. |  给液体加热 |
9.有关金属性质的叙述正确的是( )
| A. | 都具有很高的熔点 | |
| B. | 最外层电子数少于 3 个的都是金属 | |
| C. | 都能导电、传热 | |
| D. | 都只能和酸不能和碱发生化学反应 |
10.下列说法正确的是( )
| A. | CO和NO都是大气污染物,在空气中都能稳定存在 | |
| B. | Al在浓硫酸中会“钝化”能用铝槽盛放浓硫酸 | |
| C. | 四氯化碳常用作灭火剂 | |
| D. | 在碱性溶液中可以大量存在:S2O32-、AlO2-、SiO32-、S2-、Na+ |