题目内容
12.下列实验操作正确的是( )| A. |  | B. |  | ||
| C. |  检查容量瓶是否漏水 | D. |  给液体加热 |
分析 A.托盘天平的感量为0.1g;
B.量筒的规格应与液体的体积接近,减小误差;
C.上下颠倒摇匀,检验是否漏水;
D.加热时液体不能超过试管容积的$\frac{1}{3}$.
解答 解:A.托盘天平的感量为0.1g,不能称量10.05g,故A错误;
B.量筒的规格应与液体的体积接近,减小误差,应选10mL量筒,故B错误;
C.上下颠倒摇匀,检验是否漏水,操作合理,故C正确;
D.加热时液体不能超过试管容积的$\frac{1}{3}$,图中试管内液体过多,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、实验基本操作和技能、仪器的使用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
2.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
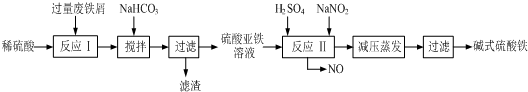
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,除去溶液中Al3+(使溶液中Al3+生成氢氧化物沉淀),该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行.
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O或Fe2++H2O+NO2-=Fe(OH)2++NO↑+H+,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是2H2O+4NO+O2=4HNO3(或2NO+O2=2NO23NO2+H2O=2HNO3+NO).(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在常温减压条件下的原因是防止蒸发时温度过高,碱式硫酸铁进一步水解生成Fe(OH)3.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH,除去溶液中Al3+(使溶液中Al3+生成氢氧化物沉淀),该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行.
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O或Fe2++H2O+NO2-=Fe(OH)2++NO↑+H+,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是2H2O+4NO+O2=4HNO3(或2NO+O2=2NO23NO2+H2O=2HNO3+NO).(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在常温减压条件下的原因是防止蒸发时温度过高,碱式硫酸铁进一步水解生成Fe(OH)3.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
3.2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应PCl3(g)+Cl2(g)?PCl5(g) 达到平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
| A. | 0.40mol | B. | 小于0.20mol | ||
| C. | 大于0.20mol | D. | 小于0.40mol,大于0.20mol |
7.纤维素等生物碳源材料可以高产率制备石墨烯(如图),下列说法正确的是( )

| A. | 石墨烯导电属于化学变化 | B. | 石墨烯与金刚石结构相同 | ||
| C. | 纤维素与淀粉互为同分异构体 | D. | 纤维素属于天然高分子化合物 |
4.从人类利用金属的历史看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,造成这个先后顺序事实的最主要因素是( )
| A. | 地壳中金属元素的含量 | B. | 金属的延展性 | ||
| C. | 金属的导电性 | D. | 金属活动性及冶炼的难易程度 |
1.一定条件下,将TiO2和焦炭放入密闭真空容器中,反应TiO2(s)+C(s)?Ti(s)+CO2 (g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法一定正确的是( )
| A. | 平衡常数减小 | B. | TiO2的质量不变 | C. | CO2的浓度不变 | D. | Ti的质量增加 |
2.下列离子反应方程式正确的是( )
| A. | 将铜插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | Ca( HCO3)2 溶液与过量 NaOH 溶液反应:HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| C. | 用食醋除水垢:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | 稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba 2++OH-═BaSO 4↓+H2O |
 ;反应中1mol氧化剂得到 (填“得到”或“失去”)6mol电子.
;反应中1mol氧化剂得到 (填“得到”或“失去”)6mol电子.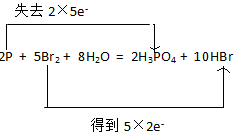 .反应中氧化剂与还原剂的物质的量之比为5:2.
.反应中氧化剂与还原剂的物质的量之比为5:2.