题目内容
8.下列热化学方程式正确的是(注:AH的绝对值均正确)( )| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g);△H=+269.8kJ/mol(反应热) | |
| D. | 2HCl(g)═Cl2(g)+H2(g);△H=-184.6kJ/mol(反应热) |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B、中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量;
C、热化学方程式是标注物质聚集状态,反应放出的热量;
D、氯化氢分解反应为吸热反应,焓变为正值.
解答 解:A、C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热)反应中生成 的氧化物水是气体,不是稳定氧化物,故A错误;
B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol(中和热),符合中和热概念,故B正确;
C、S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol(反应热),焓变不符合热化学方程式的书写,故C错误;
D、2HCl(g)═Cl2(g)+H2(g);△H=+184.6kJ/mol(反应热),反应为吸热反应,焓变为正值,故D错误;
故选B.
点评 本题考查了燃烧热、中和热、热化学方程式的书写方法和判断,关键是概念的理解,题目较简单.

练习册系列答案
相关题目
19.﹒下列有关热化学方程式的书写及对应表述均正确的是( )
| A. | 密闭容器中,9.6g 硫粉与 11.2g 铁粉混合加热生成硫化亚铁 17.6g 时,放出 19.12KJ 热量.则Fe(s)+S(s)═FeS(s)△H=-95.6KJ?mol-1 | |
| B. | 稀醋酸与 0.1mol?L-1NaOH 溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ?mol-1 | |
| C. | 已知,1molH2 完全燃烧生成液态水所放出的热量为 285.5KJ,则水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=-285.5KJ?mol-1 | |
| D. | 已知 2C(s)+O2(g)═2CO(g)△H=-221KJ?mol-1,则可知 C 的燃烧热△H=-110.5KJ?mol-1 |
16.ICl3遇水会产生大量的腐蚀性白色浓雾,有强烈的催泪性.若两种生成物之一是HCl,则另一种是( )
| A. | HIO3 | B. | HIO2 | C. | HIO | D. | ICl |
3.2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应PCl3(g)+Cl2(g)?PCl5(g) 达到平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
| A. | 0.40mol | B. | 小于0.20mol | ||
| C. | 大于0.20mol | D. | 小于0.40mol,大于0.20mol |
13.2mol O2和3mol O2的质量之比( )
| A. | 2:3 | B. | 2:1 | C. | 1:1 | D. | 4:3 |
18.用石墨作电极,电解1mol•L-1下列物质的溶液,通电一段时间后溶液的pH升高的是( )
| A. | H2 SO4 | B. | CuSO4 | C. | Na2 SO4 | D. | NaCl |
 ;反应中1mol氧化剂得到 (填“得到”或“失去”)6mol电子.
;反应中1mol氧化剂得到 (填“得到”或“失去”)6mol电子.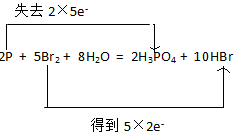 .反应中氧化剂与还原剂的物质的量之比为5:2.
.反应中氧化剂与还原剂的物质的量之比为5:2.