题目内容
8.中学化学中很多“规律”都有其使用范围,下列有关“规律”推出的结论合理的是( )| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据共价键的强弱规律,推出HF的沸点强于HCl | |
| D. | 根据无机含氧酸的强弱规律,推出HNO2的酸性强于H3PO3 |
分析 A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素;
B.主族元素中,元素最高正化合价与其族序数相等,但O、F元素除外;
C、根据分子间作用力的强弱规律;
D、含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.
解答 解:A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,所以Mg元素第一电离能大于Al元素,故A错误;
B.主族元素中,元素最高正化合价与其族序数相等,但O、F元素除外,所以卤族元素中除了F元素外其它元素最高正化合价为+7,故B错误;
C、根据分子间作用力的强弱规律,氟化氢分子间存在氢键,所以HF的沸点强于HCl,故C错误;
D、含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,在HNO2中含有一个非羟基氧,而H3PO3中无非羟基氧,所以推出HNO2的酸性强于H3PO3,故D正确;
故选D.
点评 本题考查较综合,涉及第一电离能大小判断、元素化合价与族序数的关系、分子间作用力、酸性强弱等知识点,侧重考查学生对物质结构和元素周期律等基本理论的考查,题目难度不大.

练习册系列答案
相关题目
5.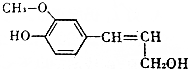 木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )
 木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )| A. | 该物质的分子式是C10H15O3,属于芳香族化合物 | |
| B. | 1mol该物质最多能与1molH2发生加成反应 | |
| C. | 1mol该物质只能与1molBr2反应 | |
| D. | 该物质可以与FeCl3溶液发生显色反应,也能发生酯化反应 |
19.已知在相同状况下,要使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量.下列说法正确的是( )
| A. | 电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应 | |
| B. | 水分解产生氢气和氧气时放出能量 | |
| C. | 相同状况下,反应2CO+O2═2CO2是一个放热反应,则反应2CO2═2CO+O2是一个吸热反应 | |
| D. | 氯化氢分解成氢气和氯气时需要吸收能量,实验氯化氢的总能量高于氢气和氯气的总能量 |
16.煤化工中两个重要反应为①C(s)+H2O(g)?H2(g)+CO(g)
△H=+131.3kJ•mol-1,②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应②中及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O(g)的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
①实验Ⅰ中,从反应开始到反应达到平衡时,H2O(g)的平均反应速率为0.16mol•L-1•min-1.
②CO(g)和H2O(g)反应的△H小于0(填“大于”“小于”或“等于”).
③实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”“减小”或“不变”).
④若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡正反应方向移动(填“向正反应方向移动”“向逆反应方向移动”“不移动”).
(4)CO、H2可用于生产甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
△H=+131.3kJ•mol-1,②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应②中及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O(g)的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
| 实验 组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
②CO(g)和H2O(g)反应的△H小于0(填“大于”“小于”或“等于”).
③实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”“减小”或“不变”).
④若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡正反应方向移动(填“向正反应方向移动”“向逆反应方向移动”“不移动”).
(4)CO、H2可用于生产甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
13.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,1 mol SO3的体积约为22.4L | |
| B. | 1 mol钠原子中含有的电子数为NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 1molFe与足量的氯气反应时,转移的电子数是2NA |
17.下列说法不正确的是( )
| A. | Na2O2可用于呼吸面具中氧气的来源 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 乙醇可与金属钠反应放出氢气 | |
| D. | 金属钠着火时,可用细沙覆盖灭火 |
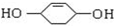 ;
;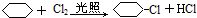
 .
.