题目内容
7.中学化学中涉及很多类似的反应,在以定条件下,某一类化学反应如下:A+B$\stackrel{一定条件}{→}$D+E+H2O
请问答下列问题:
(1)若A、D、E均含有氯元素,且A中氯元素的化合价介于D与E中的氯元素的化合价之间,写出该反应的离子方程式:Cl2+2OH-═Cl-+ClO-+H2O.
(2)若D、E均为气体且都能使澄清石灰水变浑浊,则A与B反应的化学方程式是C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(3)若E是一种极易溶于水的气体,盐D是一种干燥剂,试写出A和B反应的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)若A为金属单质,B为某元素最高价氧化物的水化物的稀溶液,写出一个符合上述反应的离子方程式:3Cu+8H++2H+=3Cu2++2NO↑+4H2O.
分析 (1)若A、D、E均含有氯元素,且A中氯元素的化合价介于D与E中的氯元素的化合价之间,判断A为氯气、B为氢氧化钠,DE为NaCl、NaClO;
(2)若D和E均为气体且都能使澄清的石灰水变浑浊,A为C,B为浓硫酸,反应为碳与浓硫酸反应生成二氧化碳、二氧化硫与水;
(3)若E是一种极易溶于水的气体,盐D是一种干燥剂,则E为NH3,D为CaCl2,A和B为NH4Cl、Ca(OH)2;
(4)若A为金属单质,B为某元素最高价氧化物的水化物的稀溶液,可以是铜和稀硝酸发生的反应.
解答 解:(1)若A、D、E中均含有氯元素,且A中的Cl的化合价介于E和D之间,氯气与氢氧化钠反应符合转化关系,则A为Cl2、B为氢氧化钠,该反应为氯气在碱性条件下的歧化反应,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(2)若D和E均为气体且都能使澄清的石灰水变浑浊,A为C,B为浓硫酸,为碳与浓硫酸反应生成二氧化碳、二氧化硫与水,反应的方程式为C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)若E是一种极易溶于水的气体,盐D是一种干燥剂,则E为NH3,D为CaCl2,A和B为NH4Cl、Ca(OH)2,AB反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)若A为金属单质,B为某元素最高价氧化物的水化物的稀溶液,可以是铜和稀硝酸发生的反应,反应的离子方程式为:3Cu+8H++2H+=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2H+=3Cu2++2NO↑+4H2O.
点评 本题考查无机物推断,基本属于开放性题目,物质的颜色、性质等是推断突破口,需要学生熟练掌握元素化合物性质及常见的特殊反应,题目难度中等.

 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案| A. | CO2和H2O | B. | NaCl和HCl | C. | CCl4和KCl | D. | Mg(OH)2和SO2 |
| A. | 用食醋和石灰水验证鸡蛋壳中含有碳酸钙 | |
| B. | 将淀粉在唾液淀粉酶的作用下水解 | |
| C. | 用米汤检验食盐中是否加了碘 | |
| D. | 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |
| A. | 反应中的Na2O2既表现氧化性,又表现还原性 | |
| B. | 反应每消耗1molSO2,Na2O2将得到2mol电子 | |
| C. | 与反应2Na2O2+CO2═2Na2CO3+O2中Na2O2的作用相同 | |
| D. | 与反应Na2O2+H2SO4═Na2SO4+H2O2中Na2O2的作用相同 |
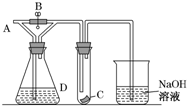 如图所示,A处通入Cl2,关闭B阀时,C处的红布看不到明显现象,开B阀后,C处红色布条逐渐褪色,则D瓶中装的不可能是( )
如图所示,A处通入Cl2,关闭B阀时,C处的红布看不到明显现象,开B阀后,C处红色布条逐渐褪色,则D瓶中装的不可能是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | Na2CO3溶液 | D. | 饱和NaCl溶液 |
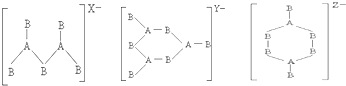
由此可知三种离子的电荷数X、Y、Z分别为( )
| A. | 2,3,4 | B. | 4,3,2 | C. | 4,2,3 | D. | 3,2,4 |
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置在空气中也会变质,检验莫尔盐是否变质的试剂是KSCN溶液.
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点.重复进行3次,测得有关数据如表:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.42 |
| Ⅲ | 0.00 | 19.92 |
②写出滴定过程中反应的离子方程式6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O.
③所测K2Cr2O7溶液的物质的量浓度为$\frac{m}{47.04}$mol/L(用含m的代数式表示).
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物.
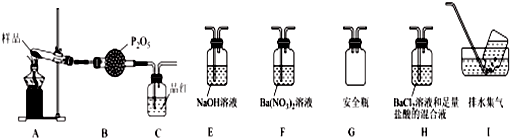
①甲同学提出猜想:分解产物可能是N2、Fe2O3、SO2、H2O四种物质.你是否同意并说明理由:不同意,N、Fe的化合价均升高,没有化合价降低的元素.
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有Fe2O3;C装置中红色褪去,说明气体产物中含有SO2;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是NaOH溶液(写一种即可).
③丙同学想利用上述装置证明分解产物中含有氨气,只需更换B、C中的试剂即可,则更换后的试剂为B碱石灰,C酚酞溶液.
④丁同学认为莫尔盐分解可能会生成N2、SO2,拟从下列装置中选择必要的装置加以证明,则正确的连接顺序从左到右依次是A、G、H、I.
| A. | 对于反应2AB(g)?A2(g)+B2(g),当容器中AB与A2的体积比不随时间变化,说明反应一定达到平衡状态 | |
| B. | 对于反应N2(g)+3H2(g)?2NH3(g),当1个N≡N键断裂的同时3个H-H键形成,说明反应一定达到平衡状态 | |
| C. | 在恒温,恒容密闭容器中如下反应:2HI(g)?H2(g)+I2(g)混合气体颜色不在变化,说明反应一定达到平衡 | |
| D. | 在恒温,恒容密闭容器中如下反应:X2(g)+Y2(g)?2Z(g)+W(s),当混合气体的平均相对分子质量或压强不随时间的变化而变化,说明反应一定达到平衡 |
| A. | 0.1mol/L HR溶液与0.1mol/L氨水等体积反应,所得溶液呈酸性 | |
| B. | NaR晶体用蒸馏水配成水溶液,PH试纸测得PH大于7 | |
| C. | 将PH=2.3的HR溶液加蒸馏水稀释10倍,PH变成2.8 | |
| D. | 常温下,0.1mol/L HR溶液的pH为2 |