题目内容
15.下列有关反应Na2O2+SO2═Na2SO4中Na2O2作用的说法正确的是( )| A. | 反应中的Na2O2既表现氧化性,又表现还原性 | |
| B. | 反应每消耗1molSO2,Na2O2将得到2mol电子 | |
| C. | 与反应2Na2O2+CO2═2Na2CO3+O2中Na2O2的作用相同 | |
| D. | 与反应Na2O2+H2SO4═Na2SO4+H2O2中Na2O2的作用相同 |
分析 A.反应Na2O2+SO2═Na2SO4中Na2O2中,过氧化钠为氧化剂,二氧化硫为还原剂;
B.二氧化硫被氧化成硫酸钠,化合价升高2价;
C.该反应中过氧化钠既是氧化剂也是还原剂;
D.过氧化钠与水硫酸的反应中,过氧化钠既是氧化剂,还是还原剂.
解答 解:反应Na2O2+SO2═Na2SO4中Na2O2中,Na2O2钠为氧化剂,SO2为还原剂,
A.该反应中过氧化钠只是氧化剂,表现的是还氧化性,不表现还原性,故A错误;
B.反应每消耗1molSO2会失去2mol电子,根据电子守恒可知Na2O2将得到2mol电子,故B正确;
C.反应2Na2O2+CO2═2Na2CO3+O2中Na2O2既是氧化剂又是还原剂,与题干反应中过氧化钠的作用不同,故C错误;
D.反应Na2O2+H2SO4═Na2SO4+H2O2中Na2O2中既是氧化剂也是还原剂,而题干反应中过氧化钠只是氧化剂,两个反应中过氧化钠的作用不同,故D错误;
故选B.
点评 本题考查了氧化还原反应,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握氧化剂、还原剂的概念及判断方法,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
5.参考表中物质的熔点,回答有关问题.
(1)钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的离子半径大小有关,随着该值的增大,熔点依次降低.
(2)硅的卤化物及硅、锗、锡、铅的氯化物熔点与相对分子质量有关,随着此值的增大,分子间作用力增大,故熔点依次升高.
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与晶体类型有关.
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SbCl4 | PbCl4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 | -70.4 | -49.5 | -36.2 | -15 |
(2)硅的卤化物及硅、锗、锡、铅的氯化物熔点与相对分子质量有关,随着此值的增大,分子间作用力增大,故熔点依次升高.
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与晶体类型有关.
3.下列有关化学用语表示正确的是( )
| A. | 乙酸的结构简式:C2H4O2 | B. | Cl-的结构示意图为 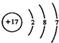 | ||
| C. | 中子数为20 的氯原子:3717Cl | D. | NH3 的电子式: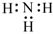 |
20.下列离子组在溶液中能大量共存的是( )
| A. | Fe3+、SO42-、I-、K+ | B. | K+、Al3+、SO42-、MnO4- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | Ba2+、NH4+、Br-、OH- |
14.氯碱工业过程中产生了大量的盐泥.某氯碱工厂的盐泥组成如表:
该工厂进一步利用盐泥生产了七水硫酸镁,设计了工艺流程如图1:
回答下列问题:
(1)反应器中加入酸溶解,反应液控制pH为5左右,反应温度在50℃左右,写出有关化学反应方程式Mg(OH)2+H2SO4═MgSO4+2H2O;CaCO3+H2SO4?CaSO4+H2O+CO2↑.
(2)在滤饼中检测到硫酸钙的成分,其原因是因为CaCO3+H2SO4?CaSO4+H2CO3,加热有H2CO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑,降低c(H2CO3),所以平衡不断向右移动,最终CaCO3生成了CaSO4.
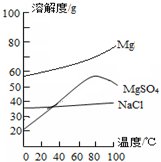
(3)已知一些盐的溶解度如图2.在滤液I中通入高温水蒸气进行蒸发结晶,为了析出晶体I,应控制温度在80℃.
(4)步骤II操作是冷却结晶、洗涤,
(5)步骤III在工业上常用的设备是D(填字母).
A.加压干燥器B.蒸馏塔C.离心机D.真空干燥器
(6)准确称取制备产品ag,将其加入到盛有V1mL c1mol/L的NaOH溶液的锥形瓶中,溶解后,加入酚酞溶液2滴,溶液变红色,再用c2mol/L的盐酸进行滴定,消耗盐酸V2mL,则样品MgSO4•7H2O的质量分数是$\frac{12.3({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{a}$%.
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | SiO2等不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |


回答下列问题:
(1)反应器中加入酸溶解,反应液控制pH为5左右,反应温度在50℃左右,写出有关化学反应方程式Mg(OH)2+H2SO4═MgSO4+2H2O;CaCO3+H2SO4?CaSO4+H2O+CO2↑.
(2)在滤饼中检测到硫酸钙的成分,其原因是因为CaCO3+H2SO4?CaSO4+H2CO3,加热有H2CO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑,降低c(H2CO3),所以平衡不断向右移动,最终CaCO3生成了CaSO4.
(3)已知一些盐的溶解度如图2.在滤液I中通入高温水蒸气进行蒸发结晶,为了析出晶体I,应控制温度在80℃.
(4)步骤II操作是冷却结晶、洗涤,
(5)步骤III在工业上常用的设备是D(填字母).
A.加压干燥器B.蒸馏塔C.离心机D.真空干燥器
(6)准确称取制备产品ag,将其加入到盛有V1mL c1mol/L的NaOH溶液的锥形瓶中,溶解后,加入酚酞溶液2滴,溶液变红色,再用c2mol/L的盐酸进行滴定,消耗盐酸V2mL,则样品MgSO4•7H2O的质量分数是$\frac{12.3({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{a}$%.
15.有关化学用语正确的是( )
| A. | 乙烯的实验式C2H4 | B. | 乙醇的结构简式C2H6O | ||
| C. | 四氯化碳的电子式  | D. | 臭氧的分子式O3 |