题目内容
15.常温下含有 ①CH3COOH ②:HCl ③:H2SO4三种溶液.(1)当它们的pH相同时,其物质的量浓度的关系是:①>②>③ (填数字编号)
(2)当它们的物质的量浓度相同时,其pH关系是①>②>③
(3)中和同一烧碱溶液,需同浓度的三种溶液的体积关系是①=②>③
(4)体积、浓度相同的①、②、③三溶液,分别与同浓度的NaOH溶液反应使pH等于7,所需NaOH溶液的体积关系是①>②=$\frac{1}{2}$③
(5)某温度下,纯水中的c(H+)=2.0x10-7mol/L,则此时溶液中的c(OH-)为2×10-7mol/L
若温度不变,滴入稀盐酸使c(H+)=5.0x10-6mol/L,则c(OH-)为8×10-9mol/L.
分析 (1)醋酸为弱酸,盐酸为一元强酸,硫酸为二元强酸,等pH时,醋酸浓度最大;
(2)物质的量浓度相同时,硫酸氢离子浓度最多,醋酸氢离子浓度最小;
(3)中和时,等浓度的三种酸,醋酸和盐酸的中和能力相同;
(4)体积和浓度相同的①、②、③三溶液,其物质的量相等,分别与同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积与酸的元数成反比;
(5)纯水中的c(H+)=c(OH-),某温度下,纯水中的c(H+)=2.0×10-7mol/L,则Kw=4.0×10-14,结合Kw计算.
解答 解:(1)pH相同溶液中氢离子浓度相同,醋酸是一元弱酸,硫酸是二元强酸、盐酸是一元强酸,假设氢离子浓度为1mol/L,则醋酸浓度大于1mol/L、盐酸浓度是1mol/L、硫酸浓度是0.5mol/L,所以其物质的量浓度的由大到小排列是 ①>②>③,故答案为:①>②>③;
(2)当它们的物质的量浓度相同时,假设都是1mol/L,醋酸中氢离子浓度小于1mol/L、硫酸中氢离子浓度是2mol/L、盐酸中氢离子浓度是1mol/L,氢离子浓度越大pH越小,所以其pH的由大到小排列是①>②>③,故答案为:①>②>③;
(3)中和等量氢氧化钠,消失同浓度酸的体积与酸电离出最终氢离子的浓度成反比,三种溶液浓度相等,硫酸是二元酸、醋酸和盐酸都是一元酸,所以最终电离出氢离子的浓度硫酸>醋酸=盐酸,所以消耗三种酸的体积大小顺序是①=②>③,故答案为:①=②>③;
(4)体积和浓度相同的①、②、③三溶液,其物质的量相等,分别与同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积与酸的元数成反比,硫酸是二元酸、醋酸和盐酸都是一元酸,所以需要烧碱溶液体积关系为 ①>②=$\frac{1}{2}$③,故答案为:①>②=$\frac{1}{2}$③;
(5)纯水中的c(H+)=c(OH-),某温度下,纯水中的c(H+)=2.0×10-7mol/L,则Kw=4.0×10-14,
若温度不变,滴入稀盐酸使c(H+)=5.0x10-6mol/L,则c(OH-)=$\frac{4×1{0}^{-14}}{5×1{0}^{-6}}$mol/L=8×10-9 mol/L,
故答案为:2×10-7;8×10-9.
点评 本题考查酸碱混合溶液定性判断,侧重考查学生分析、推断能力,明确一元酸、二元酸和碱的定量关系是解本题关键,题目难度中等.

②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
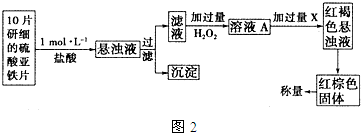
(1)水钴矿进行预处理时加入Na2SO3的主要作用是将Fe3+、Co3+还原.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,a的取值范围是5.2≤a≤7.6;过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
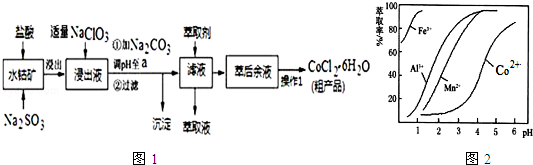
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O的含量,称取16.4g的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤、将沉淀烘干后称其质量为4,.6g,则粗产品中CoCl2•6H2O的质量分数是93%.(结果保留小数点后一位数字)
| A. | 在蒸馏水中滴加稀H2SO4,c(H+)和KW都增大 | |
| B. | 在Na2S稀溶液中,c(OH-)+c(HS-)+2c(S2-)═c(H+)+c(Na+) | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 等体积0.2mol/LHCl溶液与0.05mol/LBa(OH)2溶液混合后,溶液的pH=1 |
①过滤
②加过量的NaOH
③加适量盐酸
④加过量Na2CO3溶液
⑤加过量BaCl2溶液.
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ④②⑤①③ | D. | ⑤②④①③ |
| A. | 4 v(NH3)=5 v(O2) | B. | 5 v(O2)=6 v(H2O) | C. | 5 v(NO)=4 v(O2) | D. | 3 v(H2O)=2 v(NH3) |
| A. | SiH4比CH4稳定 | |
| B. | O2-半径比F-的小 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | HClO4、H2SO4、H3PO4的酸性依次增强 |
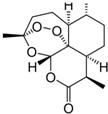 我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 青蒿素的化学式为C15H22O5 | |
| B. | 青蒿素的同分异构体可能有芳香族化合物 | |
| C. | 青蒿素可与NaOH溶液发生水解反应 | |
| D. | 青蒿素可用蒸馏水从植物提取 |