题目内容
4.下列说法正确的是( )| A. | SiH4比CH4稳定 | |
| B. | O2-半径比F-的小 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | HClO4、H2SO4、H3PO4的酸性依次增强 |
分析 A.元素的非金属性越强,其氢化物的稳定性越强;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.同一主族元素,元素的金属性随着原子序数增大而增强,元素的金属性越强,其失电子能力越强;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:A.由于C、Si同属都IVA族,且C在Si的上一周期,则C的非金属性比Si强,则CH4比SiH4稳定,故A错误;
B.O2-与F-电子层结构相同,但氧的核电荷数少,所以O2-半径比F-的大,故B错误;
C.Na和Cs同主族,Cs金属性强,则Cs随着能力大于Na,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,元素的非金属性:Cl>S>P,所以其最高价因为的水化物HClO4、H2SO4、H3PO4的酸性依次减弱,故D错误;
故选C.
点评 本题考查元素周期律,为高频考点,侧重考查学生知识综合运用能力,明确金属性、非金属性强弱判断方法及其对应的元素周期律是解本题关键,知道离子半径比较方法,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
18.下列两种化合物的结构或性质描述正确的是( )
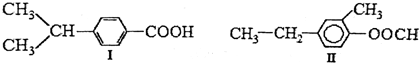
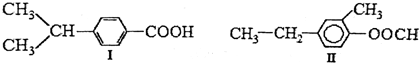
| A. | 两种物质的分子式均为C10H14O2互为同分异构体 | |
| B. | 两种物质均能发生加成和取代反应 | |
| C. | 两种物质都有甲基、苯环和羧基 | |
| D. | 两物质都含有双键因此都能使溴的四氯化碳溶液褪色 |
19.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:(1)这九种元素中化学性质最不活泼的是Ar(填元素符号).
(2)在①、②、③三种元素的最高价氧化物的水化物中,碱性最强的是KOH(填化学式).
(3)①、②、③三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号).
(4)①、③、④、⑥四种元素的离子半径由大到小的顺序依次为Al3+(填离子符号).
(5)⑦、⑧两元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式).
(6)⑥的氢化物与⑦的单质反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
(2)在①、②、③三种元素的最高价氧化物的水化物中,碱性最强的是KOH(填化学式).
(3)①、②、③三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号).
(4)①、③、④、⑥四种元素的离子半径由大到小的顺序依次为Al3+(填离子符号).
(5)⑦、⑧两元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式).
(6)⑥的氢化物与⑦的单质反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
9.NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得.工艺流程如图:
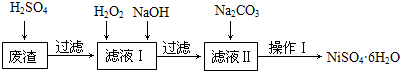
已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如表所示.
注:NiCO3是一种不溶于水易溶于强酸的沉淀.
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有AC.
A.升高反应温度B.增大压强C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示);加入NaOH调节pH的范围是5.6≤pH<8.4,为了除去溶液中的Fe3+、Cr3+离子.
(3)滤液Ⅱ的主要成分是Na2SO4、NiSO4.
(4)检验Ni2+已完全沉淀的实验方法是静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成.
(5)操作Ⅰ的实验步骤依次为:
①过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
②向沉淀中加稀的H2SO4溶液,直至恰好完全溶解;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干.

已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如表所示.
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有AC.
A.升高反应温度B.增大压强C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示);加入NaOH调节pH的范围是5.6≤pH<8.4,为了除去溶液中的Fe3+、Cr3+离子.
(3)滤液Ⅱ的主要成分是Na2SO4、NiSO4.
(4)检验Ni2+已完全沉淀的实验方法是静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成.
(5)操作Ⅰ的实验步骤依次为:
①过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
②向沉淀中加稀的H2SO4溶液,直至恰好完全溶解;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干.
13.常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
下列判断正确的是( )
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.2 | 0.2 | pH=9 |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
| A. | c1=0.2 | |
| B. | 丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-) | |
| C. | a>9 | |
| D. | 在乙组混合液中由水电离出的c(OH-)=10-5mol•L-1 |
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
 已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.E是具有果香味的酯,F是一种高聚物,可制成多种包装材料.
已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.E是具有果香味的酯,F是一种高聚物,可制成多种包装材料.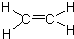 ,C的名称为乙醛.
,C的名称为乙醛.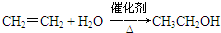 ④
④ .
.