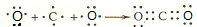题目内容
10.下列叙述正确的是( )| A. | 在蒸馏水中滴加稀H2SO4,c(H+)和KW都增大 | |
| B. | 在Na2S稀溶液中,c(OH-)+c(HS-)+2c(S2-)═c(H+)+c(Na+) | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 等体积0.2mol/LHCl溶液与0.05mol/LBa(OH)2溶液混合后,溶液的pH=1 |
分析 A.温度不变,则KW不变;
B.Na2S稀溶液中存在电荷溶液;
C.CH3COONH4为弱酸弱碱盐,促进水的电离;
D.等体积0.2mol/LHCl溶液与0.05mol/LBa(OH)2溶液混合后,盐酸过量,计算反应后的氢离子的浓度,可计算pH.
解答 解:A.KW只受温度的影响,温度不变,则KW不变,故A错误;
B.由电荷守恒可知Na2S稀溶液中存在c(OH-)+c(HS-)+2c(S2-)═c(H+)+c(Na+),故B正确;
C.NaCl为强酸强碱盐,水的电离不受影响,CH3COONH4为弱酸弱碱盐,促进水的电离,故C错误;
D.0.2mol/LHCl溶液与等体积0.05mol/LBa(OH)2溶液混合时,盐酸和氢氧化钡的物质的量之比是4:1,发生的反应方程式为2HCl+Ba(OH)2=BaCl2+2H2O,根据方程式知,混合后盐酸剩余,混合溶液中盐酸的浓度是0.05mol/L,溶液的pH>1,故D错误.
故选B.
点评 本题考查了离子浓度大小的判断、盐类的水解等知识点,为高频考点,侧重于学生的分析能力的考查,注意把握盐类水解的特点以及溶液电荷守恒的运用,难度不大.

练习册系列答案
相关题目
20.下列实验能达到实验目的且符合安全要求的是( )
| A. |  实验室制氧气 | B. |  收集氧气 | ||
| C. |  制备并检验氢气的可燃性 | D. |  浓硫酸稀释 |
18.下列两种化合物的结构或性质描述正确的是( )
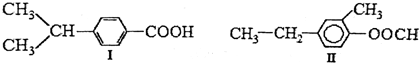
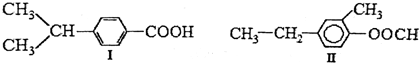
| A. | 两种物质的分子式均为C10H14O2互为同分异构体 | |
| B. | 两种物质均能发生加成和取代反应 | |
| C. | 两种物质都有甲基、苯环和羧基 | |
| D. | 两物质都含有双键因此都能使溴的四氯化碳溶液褪色 |
5.目前,世界上已经合成了几百种有机超导体,如图所示是其中之一,该分子结构如图所示.下列关于该化合物说法错误的是 ( )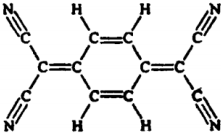

| A. | 分子中所有的氮原子在同一平面内 | B. | 属于芳香烃 | ||
| C. | 分子式为C12H4N4 | D. | 该物质易溶于水 |
2.下列有关叙述正确的是( )
| A. | 在中和滴定中,既可用标准溶液滴定待测溶液,也可用待测溶液滴定标准溶液 | |
| B. | 进行中和滴定操作中,眼睛要始终注视滴定管内溶液液面的变化 | |
| C. | 测定中和热时,两烧杯间填满碎纸的作用是固定小烧杯 | |
| D. | 若用50mL 0.55mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.50mo1•L-1的硫酸充分反应,两反应的中和热不相等 |
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.