题目内容
2.下列各组气体中,都能用浓硫酸干燥的是( )| A. | CO、H2、SO2 | B. | SO2、H2S、O2 | C. | HCl、CO2、H2S | D. | H2、SO2 、NH3 |
分析 浓硫酸具有吸水性、酸性和强氧化性,可用来干燥气体,浓硫酸一般能干燥中性和酸性气体,不能干燥碱性和强还原性气体,以此来解答.
解答 解:A.CO、H2和SO2均不与浓硫酸反应,可利用浓硫酸干燥,故A正确;
B.因浓硫酸具有强氧化性,能氧化H2S,故不能利用浓硫酸干燥,故B错误;
C.因浓硫酸具有强氧化性,能氧化H2S,但浓硫酸能干燥SO2,故C错误;
D.浓硫酸具有酸性,能与NH3反应,故不能干燥氨气,但浓硫酸能干燥氢气和二氧化硫,故D错误;
故选A.
点评 本题考查浓硫酸的吸收性及作干燥剂,明确浓硫酸与与被干燥的气体发生化学反应是解答本题的关键,题目难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
12.O3和O2在酸性条件下都能氧化海水中的I-得到碘单质,现将O3通入稀硫酸酸化的NaI溶液中进行模拟研究.
(1)用一个离子反应方程式表示该模拟实验中发生的反应:O3+6I-+6H+=3H2O+3I2
(2)为探究外界条件对I2生成速率的影响,做了如下三组实验,(其中O3、H2SO4、NaI的量都相同,溶液的体积均为20mL)填写表中的空白处.
(3)在该模拟实验中要测试是否有I2生成,需要加入一种试剂的名称是淀粉溶液(或淀粉试剂)
(4)有同学建议将FeCl2换成FeSO4更能准确的反映某种微粒对该化学反应速率有影响,则该同学的实验目的是排除Cl-的干扰,探究Fe2+对该反应速率的影响(或探究Fe2+对该反应是否有催化作用).
(1)用一个离子反应方程式表示该模拟实验中发生的反应:O3+6I-+6H+=3H2O+3I2
(2)为探究外界条件对I2生成速率的影响,做了如下三组实验,(其中O3、H2SO4、NaI的量都相同,溶液的体积均为20mL)填写表中的空白处.
| 编号 | 实验目的 | 反应物 | 反应前溶液的pH | 温度 |
| I | 对照实验 | O3+H2SO4+NaI | 5 | 25℃ |
| II | ① 探究FeCl2对反应速率的影响 | O3+H2SO4+NaI+FeCl2 | 5 | ? |
| III | 探究温度对速率的影响 | O3+H2SO4+NaI | ③ 5 | 5℃ |
(4)有同学建议将FeCl2换成FeSO4更能准确的反映某种微粒对该化学反应速率有影响,则该同学的实验目的是排除Cl-的干扰,探究Fe2+对该反应速率的影响(或探究Fe2+对该反应是否有催化作用).
17.下列有关硅的叙述中,正确的是( )
| A. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位 | |
| B. | 硅的化学性质不活泼,在常温下不与任何物质反应 | |
| C. | 硅在电子工业中是最重要的半导体材料 | |
| D. | 硅的性质很稳定,能以单质的形式存在于自然界中 |
7.下列化学用语描述中不正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | K2O的电子式: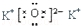 | |
| C. | 2-乙基-1,3-丁二烯分子的键线式: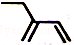 | |
| D. | 比例模型  可以表示CO2分子或SiO2 可以表示CO2分子或SiO2 |
14.短周期主族元素W、R、X、Y、Z的原子序数依次增大,W的原子半径是周期表中所有元素中最小的,R是地壳中含量最多的元素,X与W同主族,Y最外层电子数是最内层电子数的3倍.下列说法正确的是( )
| A. | 原子半径:R<Z<Y | B. | 简单氢化物的热稳定性:R>Y | ||
| C. | R与Y只能形成一种化合物 | D. | 最高价氧化物的水化物酸性:Y>Z |
11.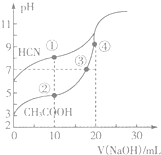 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示.下列说法不正确的是( )
 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1的CH3COOH溶液和HCN溶液,滴定曲线如图所示.下列说法不正确的是( )| A. | 点①溶液的c(CN-)<点②溶液的c(CH3COO-) | |
| B. | 点②溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 点③溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 点④溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |

 分子中,处于同一平面上的原子数最多可能有16个.
分子中,处于同一平面上的原子数最多可能有16个.