题目内容
6.下列有关物质的性质与应用不相对应的是( )| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 淀粉溶液遇碘变成蓝色,可用于检验碘单质的存在 | |
| C. | Fe在常温下遇浓硫酸发生钝化,可用铁制容器盛放冷的浓硫酸 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
分析 A.SO2用于漂白纸浆是由于具有漂白性;
B.淀粉遇到碘单质显示蓝色是淀粉的特性;
C.铁、铝在常温下与浓硫酸、浓硝酸发生钝化;
D.Zn的活泼性较强,在锌锰干电池中作负极材料.
解答 解:A.SO2用于漂白纸浆是由于具有漂白性,反应类型为化合反应,与氧化性、还原性无关,故A错误;
B.碘单质遇到淀粉显示蓝色,据此可检验碘单质的存在情况,故B正确;
C.Fe在常温下遇浓硫酸发生钝化,阻止了反应的继续进行,故可用铁制容器盛放冷的浓硫酸,故C正确;
D.Zn为活泼金属,具有良好的导电性,易失去电子,可作原电池的负极,故D正确;
故选A.
点评 本题考查较为综合,考查了物质性质方案的设计与评价,题目难度不大,注意把握盐类水解的原理和应用,学习中注意掌握常见元素化合物的知识.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列实验操作或对实验事实的叙述不正确的是( )
| A. | 取用钠、钾、白磷时,没用完的药品要放回原瓶 | |
| B. | 用pH试纸测得氯水的pH为2 | |
| C. | 氯水、硝酸银溶液存放在配有磨口塞的棕色细口瓶中 | |
| D. | 金属钠着火时,用细沙覆盖灭火 |
15.目前用14C呼气试验来检查幽门螺杆菌,从而达到检测和预防胃溃疡、慢性胃炎、胃癌的目的,下列说法正确的是( )
| A. | 14CO2的结构式为O═14C═O | B. | 14CO2和12CO2互为同分异构体 | ||
| C. | 14C和12C互为同素异形体 | D. | 14CO2和Na218O2反应生成15O2 |
3.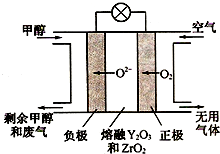 铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H
(1)已知:
①3Fe(s)+2O2(g)?Fe3O4(s)△H 1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按如表所示 加入物质,在t℃时反应经过一段时间后达到平衡.
①甲容器中H2O的平衡转化率为33.3%(结果保留一位小数)
②下列说法正确的是B(填序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(3)若将(2)中装置改为恒容绝热(不与外界交换能量)的装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见下表:
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的百分含量按由大到小的顺序排列B>C>A(用A、B、C表示).
(4)一种以甲醇做燃料的电池示意图如图,写出该电池放电时负极的电极反应式:CH3OH-6e-+3O2-=CO2↑+2H2O.
 铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H(1)已知:
①3Fe(s)+2O2(g)?Fe3O4(s)△H 1=-1118.4kJ/mol
②2H2(g)+O2(g)?2H2O(g)△H2=-483.8kJ/mol
③2H2(g)+O2(g)?2H2O(l)△H3=-571.8kJ/mol
则△H=-150.8KJ/mol(计算结果保留一位小数).
(2)在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按如表所示 加入物质,在t℃时反应经过一段时间后达到平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法正确的是B(填序号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(3)若将(2)中装置改为恒容绝热(不与外界交换能量)的装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
(4)一种以甲醇做燃料的电池示意图如图,写出该电池放电时负极的电极反应式:CH3OH-6e-+3O2-=CO2↑+2H2O.
 向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.
向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.
 或
或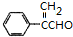 .
.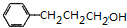 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$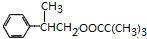 +H2O或(CH3)3CCOOH+
+H2O或(CH3)3CCOOH+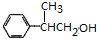 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$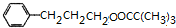 +H2O.
+H2O. .
.