题目内容
3.氢氟酸是一种弱酸,可用来刻蚀玻璃.已知25℃时:①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列有关说法正确的是( )
| A. | 氢氟酸的电离方程式及热效应可表示为:HF(aq)?F-(aq)+H+(aq)△H=+10.4 kJ•mol-1 | |
| B. | NaF水解时的热化学方程式为F-(aq)+H2O(aq)=HF(aq)+OH-(aq)△H=+67.7KJ•mol | |
| C. | 溶液温度升高后,一定能促进弱电解质的电离 | |
| D. | 将含有0.1molHF与0.1molNaOH的两种物质混合后放出的热量为6.77KJ |
分析 A、利用盖斯定律将①-②可得氢氟酸的电离方程式及热效应;
B、反应热的单位是kJ•mol-1;
C、弱电解质的电离吸热;
D、两种物质的状态不知.
解答 解:A、利用盖斯定律将①-②可得HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1,故A错误;
B、反应热的单位是kJ•mol-1,所以NaF水解时的热化学方程式为F-(aq)+H2O(aq)=HF(aq)+OH-(aq)△H=+67.7KJ•mol-1,故B错误;
C、电离吸热,升温能够促进弱电解质的电离,故C正确;
D、两种物质的状态不知,如氢氧化钠固体溶于水要放热,所以热效应要发生改变,故D错误;
故选C.
点评 本题考查了热化学方程式书写和盖斯定律应用,中和热概念实质理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
13.已知:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.5kJ/mol
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283.0kJ/mol
则反应C(s)+O2(g)═CO2(g)的反应热为( )
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283.0kJ/mol
则反应C(s)+O2(g)═CO2(g)的反应热为( )
| A. | 172.5 kJ/mol | B. | -172.5 kJ/mol | C. | 393.5 kJ/mol | D. | -393.5 kJ/mol |
15.目前用14C呼气试验来检查幽门螺杆菌,从而达到检测和预防胃溃疡、慢性胃炎、胃癌的目的,下列说法正确的是( )
| A. | 14CO2的结构式为O═14C═O | B. | 14CO2和12CO2互为同分异构体 | ||
| C. | 14C和12C互为同素异形体 | D. | 14CO2和Na218O2反应生成15O2 |
12.下列离子方程式书写正确的是( )
| A. | 硫酸铝中加入过量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝与盐酸反应:2Al(OH)3+6H+═2Al3++6H20 | |
| C. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 偏铝酸钠溶液与适量稀硝酸反应:AlO2-+H++H20═Al(OH)3↓ |
20.氮元素能形成多种多样的化合物.
(1)己知N2O4(g)═2NO2(g)△H=+57.20kJ/mol,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如表所示:
①c(X)代表NO2(填化学式)的浓度,该反应的平衡常数K=0.9.
②20min时改变的条件是增大二氧化氮浓度;重新达到平衡时,NO2的转化率将b(填选项前字母).
a.增大 b.减小 c.不变 d.无法判断
③t℃时,下列情况不能说明该反应处于平衡状态的是A;
A.混合气体的密度保持不变 B.混合气体的颜色不再变化
C.混合气体的气体压强保持不变 D.N2O4 与NO2的物质的量比为10:3
④若反应在t℃进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时v(正)>v(逆)(填“>”、“<”或“=”).
(2)已知2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225kJ/mol
则使1mol N2O4(l)完全分解成相应的原子时需要吸收的能量是1793kJ.
(1)己知N2O4(g)═2NO2(g)△H=+57.20kJ/mol,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如表所示:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
②20min时改变的条件是增大二氧化氮浓度;重新达到平衡时,NO2的转化率将b(填选项前字母).
a.增大 b.减小 c.不变 d.无法判断
③t℃时,下列情况不能说明该反应处于平衡状态的是A;
A.混合气体的密度保持不变 B.混合气体的颜色不再变化
C.混合气体的气体压强保持不变 D.N2O4 与NO2的物质的量比为10:3
④若反应在t℃进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时v(正)>v(逆)(填“>”、“<”或“=”).
(2)已知2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225kJ/mol
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ/mol) | 390 | 190 | 946 | 460 |
 向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.
向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3→Fe(NO3)3+NO↑+H2O.
 或
或 .
. $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O或(CH3)3CCOOH+
+H2O或(CH3)3CCOOH+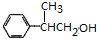 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$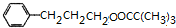 +H2O.
+H2O. .
.