题目内容
6.常温下,将V1 mL pH=12的NaOH溶液与V2 mL c (H+)=0.01mol•L-1的HF溶液混合,下列说法正确的是( )
| A. | 若混合后溶液中c(H+)>c(OH-),则一定有V1<V2 | |
| B. | 若V1=V2,则二者混合后的溶液中pH>7 | |
| C. | 混合溶液中可能存在:c ( F-)>c (H+)>c (Na+)>c( OH-) | |
| D. | 二者恰好反应完时,则所得溶液中c(F-)=c (Na+) |
分析 常温下pH=12的NaOH溶液的浓度为0.01mol/L,HF溶液中c(H+)=0.01mol•L-1,则HF溶液的浓度大于0.01mol/L,
A.溶液中c(H+)>c(OH-),反应后溶液呈酸性,由于HF浓度大于NaOH溶液,无法判断V1、V2大小;
B.V1=V2时,HF过量,反应后溶液呈酸性;
C.当加入氢氧化钠溶液较少时,该关系可以成立;
D.恰好反应生成是NaF,氟离子水解溶液呈碱性,结合电荷守恒判断.
解答 解:常温下pH=12的NaOH溶液的浓度为0.01mol/L,HF溶液中c(H+)=0.01mol•L-1,则HF溶液的浓度大于0.01mol/L,
A.若混合后溶液中c(H+)>c(OH-),说明反应后溶液呈酸性,由于HF的浓度大于NaOH,则溶液呈酸性时无法比较V1、V2大小,故A错误;
B.若V1=V2,由于HF为弱酸,其浓度大于NaOH溶液,反应后HF过量,溶液呈酸性,则二者混合后溶液的pH<7,故C错误;
C.当加入少量NaOH溶液时,溶液中可以满足:c ( F-)>c (H+)>c (Na+)>c( OH-),故C正确;
D.二者恰好反应完时,反应后溶质为NaF,溶液呈碱性,则c (H+)<c( OH-)根据电荷守恒可知:c(F-)<c (Na+),故D错误;
故选C.
点评 本题考查溶液酸碱性与溶液pH的计算,题目难度中等,明确弱电解质的电离特点为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
16.对于可逆反应A(g)+3B(s)?C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
| A. | v(A)=2 mol•L-1•min-1 | B. | v(B)=1.2 mol•L-1•s-1 | ||
| C. | v(D)=0.4 mol•L-1•min-1 | D. | v(C)=0.1 mol•L-1•s-1 |
1.下列说法或表述正确的是( )
①“PM2.5”是细小颗粒物悬浮在空气中形成胶体,严重危害人体健康
②纯碱既属于正盐又属于钠盐和碳酸盐
③相同温度下,氢氧化钠溶液的导电能力与氨水溶液强
④丁达尔效应可用于区别溶液和胶体,烟、云、雾均为胶体,能产生丁达尔效应.
⑤钢铁的吸氧腐蚀,负极发生反应:Fe-2e-═Fe2+.
①“PM2.5”是细小颗粒物悬浮在空气中形成胶体,严重危害人体健康
②纯碱既属于正盐又属于钠盐和碳酸盐
③相同温度下,氢氧化钠溶液的导电能力与氨水溶液强
④丁达尔效应可用于区别溶液和胶体,烟、云、雾均为胶体,能产生丁达尔效应.
⑤钢铁的吸氧腐蚀,负极发生反应:Fe-2e-═Fe2+.
| A. | ①②④⑤ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
11.硼是第IIIA族元素,单质硼在加热条件下能与多种非金属反应.某同学欲利用氯气和单质硼反应制备三氯化硼.已知BCl3的沸点为12.5℃,熔点为-107.3℃,遇水剧烈反应.
(1)选用如图所示的装置(可以重复选用)进行实验,装置依次连接的合理顺序为ABDCEDF.
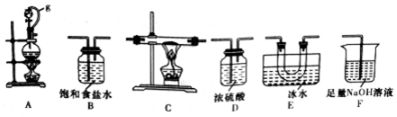
(2)图中g管的作用是保持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶,装置E的作用是冷凝并收集BCl3.
(3)开始实验时,先点燃A(填“A”或“B”)处的酒精灯.
(4)请写出BCl3遇水变质的化学方程式BCl3+3H2O=H3BO3+3HCl.
(5)硼酸是一元弱酸,其钠盐化学式为Na,则硼酸在水中电离方程式是H3BO3+H2O?[B(OH)4]-+H+.
(6)实验完成后,某同学向F (溶液中含有0.05mol/LNaC1 0、0.05mol/LNaCl、0.1mol/L NaOH)中滴加品红溶液,发现溶液褪色.现设计实验探究溶液褪色的原因,请将表中数据补充完整,完成实验方案.
x=4.0,结论:NaClO使品红溶液褪色,溶液碱性越强褪色越慢.
(1)选用如图所示的装置(可以重复选用)进行实验,装置依次连接的合理顺序为ABDCEDF.

(2)图中g管的作用是保持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶,装置E的作用是冷凝并收集BCl3.
(3)开始实验时,先点燃A(填“A”或“B”)处的酒精灯.
(4)请写出BCl3遇水变质的化学方程式BCl3+3H2O=H3BO3+3HCl.
(5)硼酸是一元弱酸,其钠盐化学式为Na,则硼酸在水中电离方程式是H3BO3+H2O?[B(OH)4]-+H+.
(6)实验完成后,某同学向F (溶液中含有0.05mol/LNaC1 0、0.05mol/LNaCl、0.1mol/L NaOH)中滴加品红溶液,发现溶液褪色.现设计实验探究溶液褪色的原因,请将表中数据补充完整,完成实验方案.
| 实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.2mol/LNaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| ① | 4.0 | 0 | 0 | x | 3滴 | 较快褪色 |
| ② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
| ③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
18.化学与生活密切相关,下列有关说法正确的是( )
| A. | 植物油久置会出现油脂的酸败现象,是因为油脂发生了水解 | |
| B. | 有机玻璃、合成橡胶、涤纶都是由加聚反应制得的 | |
| C. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| D. | 将已成熟的水果放入未成熟的水果中并密封,可加速水果成熟 |
15.(1)第四周期的某主族元素,其第一至五电离能数据如图1所示,则该元素对应原子的M层电子排布式为3s23p6.
(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是SiH4.
(3)化合物(CH3)3N与盐酸反应生成【(CH3)3 NH】+,该过程新生成的化学键为b.(填序号)
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因化合物(CH3)3N为极性分子且可与水分子间形成氢键
(4)CO2在高温高压下所形成的晶体其晶胞如图3所示.该晶体的熔点比SiO2晶体高(选填“高”或“低”),该晶体中碳原子轨道的杂化类型为sp3.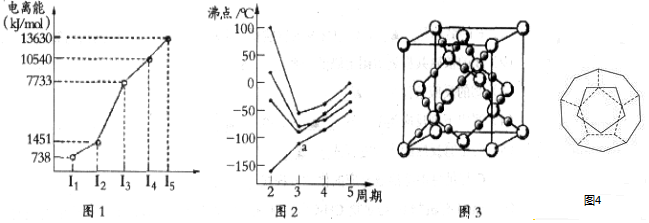
(5)如图4为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
则:C20分子共有12个正五边形,共有30条棱边.
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.试推断Ni2+的水合离子为有(填“有”或“无”)色离子,依据是Ni2+的3d轨道上有未成对电子.
(7)晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞.已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1.测知FexO晶体密度为p=5.71g•cm-3,晶胞边长为4.28×10-10m,FexO中x值(精确至0.01)为0.92.
(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是SiH4.
(3)化合物(CH3)3N与盐酸反应生成【(CH3)3 NH】+,该过程新生成的化学键为b.(填序号)
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因化合物(CH3)3N为极性分子且可与水分子间形成氢键
(4)CO2在高温高压下所形成的晶体其晶胞如图3所示.该晶体的熔点比SiO2晶体高(选填“高”或“低”),该晶体中碳原子轨道的杂化类型为sp3.

(5)如图4为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
则:C20分子共有12个正五边形,共有30条棱边.
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.试推断Ni2+的水合离子为有(填“有”或“无”)色离子,依据是Ni2+的3d轨道上有未成对电子.
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
16.茚满( )可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )
)可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )
 )可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )
)可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )| A. | 23:3 | B. | 3:23 | C. | 23:6 | D. | 6:23 |