题目内容
4.等质量并且均过量的两份锌粉a和b(粉末表面积可视为相同,分别加入等体积等物质的量浓度的稀硫酸中,同时向a中加入少量硫酸铜,图表示产生H2的体积(V)与时间(t)的关系正确的是( )| A. | 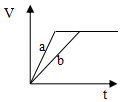 | B. | 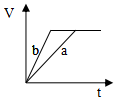 | C. | 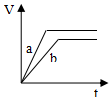 | D. | 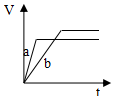 |
分析 反应均发生Zn+2H+═Zn2++H2↑,Zn过量,则相同体积、相同物质的量浓度的稀硫酸完全反应,生成氢气相同,且a中加入少量硫酸铜溶液,构成Cu、Zn原电池,加快反应的速率,以此来解答.
解答 解:由题意可知,反应均发生Zn+2H+═Zn2++H2↑,Zn过量,则相同体积、相同物质的量浓度的稀硫酸完全反应,生成氢气相同,
且a中加入少量硫酸铜溶液,构成Cu、Zn原电池,加快反应的速率,所以a反应速率快,达到反应结束时的时间短,显然只有A图象符合,
故选A.
点评 本题考查影响化学反应速率的因素,注意原电池加快反应速率及Zn过量是解答本题的关键,明确图象中线的意义即可解答,题目难度中等.

练习册系列答案
相关题目
15.(1)第四周期的某主族元素,其第一至五电离能数据如图1所示,则该元素对应原子的M层电子排布式为3s23p6.
(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是SiH4.
(3)化合物(CH3)3N与盐酸反应生成【(CH3)3 NH】+,该过程新生成的化学键为b.(填序号)
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因化合物(CH3)3N为极性分子且可与水分子间形成氢键
(4)CO2在高温高压下所形成的晶体其晶胞如图3所示.该晶体的熔点比SiO2晶体高(选填“高”或“低”),该晶体中碳原子轨道的杂化类型为sp3.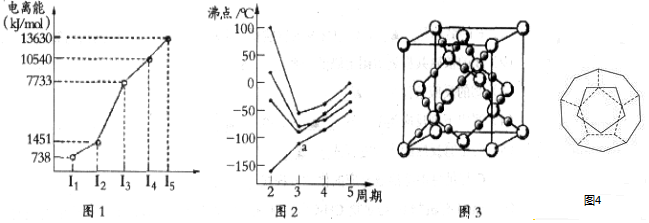
(5)如图4为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
则:C20分子共有12个正五边形,共有30条棱边.
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.试推断Ni2+的水合离子为有(填“有”或“无”)色离子,依据是Ni2+的3d轨道上有未成对电子.
(7)晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞.已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1.测知FexO晶体密度为p=5.71g•cm-3,晶胞边长为4.28×10-10m,FexO中x值(精确至0.01)为0.92.
(2)如图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是SiH4.
(3)化合物(CH3)3N与盐酸反应生成【(CH3)3 NH】+,该过程新生成的化学键为b.(填序号)
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因化合物(CH3)3N为极性分子且可与水分子间形成氢键
(4)CO2在高温高压下所形成的晶体其晶胞如图3所示.该晶体的熔点比SiO2晶体高(选填“高”或“低”),该晶体中碳原子轨道的杂化类型为sp3.

(5)如图4为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
则:C20分子共有12个正五边形,共有30条棱边.
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.试推断Ni2+的水合离子为有(填“有”或“无”)色离子,依据是Ni2+的3d轨道上有未成对电子.
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
19.下列关于如图所示原电池装置的叙述中,正确的是( )


| A. | 铜片是负极 | B. | 氢离子在铜片表面被还原 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 铜片质量逐渐减少 |
16.茚满( )可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )
)可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )
 )可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )
)可用作航空燃料的防震剂、橡胶工业防震剂等.1mol茚满与氧气、氢气反应,最多消耗氧气和氢气的物质的量之比是( )| A. | 23:3 | B. | 3:23 | C. | 23:6 | D. | 6:23 |
9.下列物质中可以作为混凝剂的是( )
| A. | 氯化钠 | B. | 氯气 | C. | 小苏打 | D. | 明矾 |
10.在下列叙述仪器“0”刻度位置正确的是( )
| A. | 在滴定管上端 | B. | 在量筒的上端 | ||
| C. | 在托盘天平刻度尺的正中 | D. | 在容量瓶的上端 |
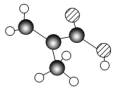 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). .
.