题目内容
 Ⅰ.(1)事实证明,原电池中发生的反应通常是放热反应.利用下列化学反应可以设计成原电池的是
Ⅰ.(1)事实证明,原电池中发生的反应通常是放热反应.利用下列化学反应可以设计成原电池的是A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2H2(g)+O2(g)=2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应式为
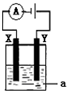
Ⅱ.电解原理在化学工业中有着广泛的应用.如图所示电解池,其中a为CuSO4溶液,X和Y是两块惰性电极板,则电解时的化学方程式为
考点:电解原理,原电池和电解池的工作原理
专题:电化学专题
分析:Ⅰ、(1)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
(2)氢氧燃料碱性电池中,负极上氢气失去电子;
Ⅱ、根据电解硫酸铜溶液电解电极反应的工作原理知识来回答.
(2)氢氧燃料碱性电池中,负极上氢气失去电子;
Ⅱ、根据电解硫酸铜溶液电解电极反应的工作原理知识来回答.
解答:
解:Ⅰ、(1)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;
故答案为:C;
(2)以KOH溶液为电解质溶液,氢氧燃料碱性电池中,负极上氢气失去电子,负极反应为H2+2OH--2e-=2H2O;
故答案为:H2+2OH--2e-=2H2O;
Ⅱ.若X和Y均为惰性电极,a为CuSO4溶液,则电解时的总化学反应方程式为2CuSO4+2H2O
2Cu+O2↑+2H2SO4,通电一段时间后,转移了0.4mole-,若想使电解质溶液恰好恢复到电解前的浓度和pH,依据电子守恒可知,生成铜0.2mol,依据少什么加什么的原则,所以可以向所得溶液中加入CuO粉末,依据铜元素守恒得到氧化铜质量=0.2mol×80g/mol=16g;
故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;16g;CuO.
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;
故答案为:C;
(2)以KOH溶液为电解质溶液,氢氧燃料碱性电池中,负极上氢气失去电子,负极反应为H2+2OH--2e-=2H2O;
故答案为:H2+2OH--2e-=2H2O;
Ⅱ.若X和Y均为惰性电极,a为CuSO4溶液,则电解时的总化学反应方程式为2CuSO4+2H2O
| ||
故答案为:2CuSO4+2H2O
| ||
点评:本题考查原电池和电解池的原理分析和电极反应,明确原电池与氧化还原反应的关系及负极发生氧化反应,电解池中 电子守恒的计算是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
“绿色化学”作为未来化学工业发展的方向和基础,越来越受到各国政府、企业和学术界的关注,下列说法符合“绿色化学”基本原则的是( )
| A、对化工厂的废气、废水、废渣进行处理 |
| B、尽可能地节约使用不可再生资源,最大限度地减少废弃物 |
| C、在化工厂周围种草、种花、种树,使工厂成为花园式工厂 |
| D、绿色化学的核心就是用化学原理对环境污染进行有效治理 |

 现有A、B、C、D、E、F六种物质,其中A、B、C是由短周期元素组成的单质,一定条件下转化关系如图:请回答:
现有A、B、C、D、E、F六种物质,其中A、B、C是由短周期元素组成的单质,一定条件下转化关系如图:请回答:


