题目内容
已知分解1mol H2O2放出热量98kJ.在含少量I-的溶液中,H2O2分解的机理为H2O2+I--→H2O+IO- 慢 H2O2+IO--→H2O+O2+I- 快下列有关该反应的说法正确的是( )
| A、反应速率与I-浓度有关 |
| B、IO-是该反应的催化剂 |
| C、当反应放出98 kJ的热量时会生成1 mol O2 |
| D、v(H2O2)=v(H2O)=v(O2) |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、反应速率的快慢主要决定于反应速率慢的第一步反应;
B、反应的催化剂是I-;
C、分解1mol过氧化氢放出的热量是其△H,然后求反应放出98 kJ的热量时会生成氧气的物质的量;
D、在一个化学反应中,用各物质表示的速率之比等于化学计量数之比.
B、反应的催化剂是I-;
C、分解1mol过氧化氢放出的热量是其△H,然后求反应放出98 kJ的热量时会生成氧气的物质的量;
D、在一个化学反应中,用各物质表示的速率之比等于化学计量数之比.
解答:
解:A、已知:①H2O2+I-→H2O+IO- 慢 ②H2O2+IO-→H2O+O2+I- 快,过氧化氢分解快慢决定于反应慢的①,I-是①的反应物之一,其浓度大小对反应不可能没有影响,例如,其浓度为0时反应不能发生,故A正确;
B、将反应①+②可得总反应方程式,反应的催化剂是I-,IO-只是中间产物,故B错误;
C、当反应放出98 kJ的热量时会生成0.5mol O2,故C错误;
D、因为反应是在含少量I-的溶液中进行的,溶液中水的浓度是常数,不能用其浓度变化表示反应速率,故D错误;
故选:A.
B、将反应①+②可得总反应方程式,反应的催化剂是I-,IO-只是中间产物,故B错误;
C、当反应放出98 kJ的热量时会生成0.5mol O2,故C错误;
D、因为反应是在含少量I-的溶液中进行的,溶液中水的浓度是常数,不能用其浓度变化表示反应速率,故D错误;
故选:A.
点评:本题目主要考查催化剂、活化能、化学反应速率的相关知识,题目难度不大.

练习册系列答案
相关题目
已知在一定条件下有CO(g)+H2O(g)?CO2(g)+H2(g),在某一容积为2L的密闭容器中,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=a kJ/mol,反应达平衡后,测得c(CO):c(CO2)=3:2,下列说法正确的是( )
| A、反应放出的热量为0.04a KJ |
| B、平衡时H2O的转化率为40% |
| C、若将容器的体积压缩为1L,有利于该反应平衡正向移动 |
| D、判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等 |
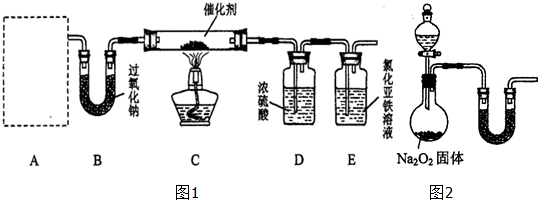
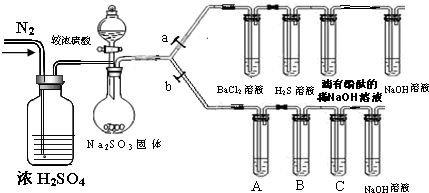
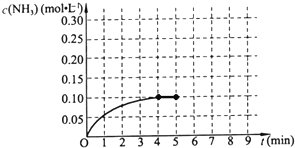 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应: