题目内容
8.有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成;
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;
③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成.
(1)根据上述实验现象,判断原白色粉末中肯定含有CaCl2、K2CO3,可能含有Ba(NO3)2.
(2)写出上述过程中一定发生的离子反应方程式:Ca2++CO32-=CaCO3↓、CaCO3+2H+=Ca2++CO2↑+H2O、Ag++Cl-=AgCl↓.
分析 ①将部分粉末加入水中,振荡,有白色沉淀生成,白色沉淀为碳酸钡或碳酸钙,则一定有K2CO3;
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生,气体为二氧化碳;
③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成,白色沉淀为AgCl,则原混合物中一定含CaCl2,以此来解答.
解答 解:①将部分粉末加入水中,振荡,有白色沉淀生成,白色沉淀为碳酸钡或碳酸钙,则一定有K2CO3;
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生,气体为二氧化碳;
③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成,白色沉淀为AgCl,则原混合物中一定含CaCl2,
(1)由上述实验现象及分析可知,原白色粉末中肯定含有CaCl2、K2CO3,可能含有Ba(NO3)2,
故答案为:CaCl2、K2CO3;Ba(NO3)2;
(2)有关反应的离子方程式为Ca2++CO32-=CaCO3↓、CaCO3+2H+=Ca2++CO2↑+H2O、Ag++Cl-=AgCl↓,
故答案为:Ca2++CO32-=CaCO3↓、CaCO3+2H+=Ca2++CO2↑+H2O、Ag++Cl-=AgCl↓.
点评 本题考查无机物的推断,为高频考点,把握物质之间的反应及现象为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
18.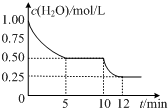 在2L密闭容器中进行反应C (s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确的是( )
在2L密闭容器中进行反应C (s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确的是( )
 在2L密闭容器中进行反应C (s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确的是( )
在2L密闭容器中进行反应C (s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确的是( )| A. | 0~5min内,v (H2)=0.05mol/(L•min) | |
| B. | 5min时该反应的K值一定小于12 min时的K值 | |
| C. | 10 min时,改变的外界条件可能是减小压强 | |
| D. | 5min时该反应的v (正)大于11 min 时的v (逆) |
16.某一重要烃的衍生物,其结构简式如图所示,下列说法中不正确的是( )
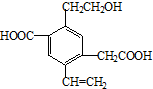

| A. | 该物质在Cu或Ag催化作用下加热,能够被氧化为相应的醛 | |
| B. | 可以用酸性高锰酸钾溶液检验,紫红色褪去,证明其含有碳碳双键 | |
| C. | 1mol该有机物,一定条件下最多可以和4molH2加成 | |
| D. | 该物质消耗Na、NaHCO3、Cu(OH)2的物质的量之比为3:2:1 |
3.室温下,下列溶液中粒子浓度关系不正确的是( )
| A. | pH=1 的 NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与 0.1 mol•L-1NaOH 溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | |
| C. | CH3COONa 和 CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 含等物质的量的 NaHC2O4和 Na2C2O4的溶液:2 c(Na+)=3c(HC2O4-)+3c(C2O42-)+3c(H2C2O4) |
13.化学与人类生产、生活密切相关.下列叙述正确的是( )
| A. | 8.12天津爆炸事件后,为处理现场散落的剧毒物NaCN,应喷洒双氧水 | |
| B. | 明矾和高铁酸盐都可用于饮用水的处理,因为它们均能杀菌消毒 | |
| C. | 向煤中加入适量石灰石,使煤燃烧产生的SO2最终生成CaSO3,可减少对大气的污染 | |
| D. | 氢氧化铝、碳酸钠都是常见的胃酸中和剂 |
17.在如图所示的8个装置中,属于原电池的是( )


| A. | ②④ | B. | ③④⑤ | C. | ①④⑧ | D. | ②④⑥⑦ |
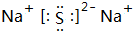 ,D原子的质子数和中子数相等,D的原子组成符号为1632 S.
,D原子的质子数和中子数相等,D的原子组成符号为1632 S.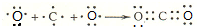 .
.