题目内容
6.有关盐类水解的说法不正确的是( )| A. | 盐类水解是酸碱中和反应的逆反应 | |
| B. | 盐类水解的结果使盐溶液不一定呈中性 | |
| C. | 盐类水解的结果使水的电离程度减小 | |
| D. | 盐类水解的结果使水的电离程度增大 |
分析 盐类水解实质是弱离子交换水电离出的氢离子或氢氧根离子生成弱电解质的过程,盐类水解生成酸和碱是中和反应的逆反应,弱酸根水解显碱性,弱碱阳离子水解显酸性,据此分析.
解答 解:A、盐类水解反应是盐与水反应生成酸和碱是中和反应的逆反应,故A正确;
B、弱酸根水解显碱性,弱碱阳离子水解显酸性,所以盐类水解的结果使盐溶液不一定呈中性,故B正确;
C、盐类水解实质是弱离子交换水电离出的氢离子或氢氧根离子生成弱电解质的过程,促进的水的电离,使水的电离程度增大,故C错误;
D、盐类水解实质是弱离子交换水电离出的氢离子或氢氧根离子生成弱电解质的过程,促进的水的电离,使水的电离程度增大,故D正确;
故选C.
点评 本题考查了盐类水解的原理、水解实质理解应用,掌握基础是关键,题目较简单,注意把握盐的水解对水的电离的影响.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法不正确的是( )
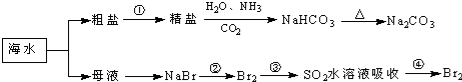

| A. | 工业上通过电解熔融状态MgCl2制取金属镁 | |
| B. | 在第②、④步骤中,溴元素均被氧化 | |
| C. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| D. | 制取NaHCO3的反应是利用其溶解度小于NaCl |
14.下列化合物中不能使酸性高锰酸钾溶液褪色的是( )
| A. |  | B. | CH2═CHCH2OH | C. |  |
1.成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒,下列有关砷及其化合物说法错误的是( )
| A. | 砒霜不是碱性氧化物 | B. | Na3As04是可熔性的正盐 | ||
| C. | 砒霜有剧毒,具有还原性 | D. | AsH3是氢化物,稳定性较强 |
11.将4mol NaHCO3和2mol Na2O2固体混合,在加热条件下使其充分反应,则所得固体的物质的量为( )
| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
18.将0.2mol/L HF溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显酸性,下列关系不正确的是( )
| A. | c(HF)<c(F-) | B. | c(Na+)<c(F-) | ||
| C. | c(F-)-c(HF)=c(H+)-c(OH-) | D. | c(HF)+c(F-)=0.1mol/L |
15.常温下,下列各组离子,在指定环境中一定能大量共存的是( )
| A. | pH<7的溶液中:Al3+、K+、SO32-、Cl- | |
| B. | 加入铝粉能放出氢气的溶液中:CO32-、AlO2-、I-、NO3- | |
| C. | 能使pH试纸变深蓝色的溶液中:S2-、SO32-、S2O32-、SO42- | |
| D. | 由水电离出的[OH-]=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl- |
17.下列叙述不正确的是( )
| A. | 在镀件上电镀铜时,可用金属铜作阳极 | |
| B. | 镀层破损后,白铁(镀锌)比马口铁(镀锡)更易被腐蚀 | |
| C. | 工业上电解饱和食盐水制烧碱,用阳离子交换膜阻止OH-移向阳极 | |
| D. | 钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应 |
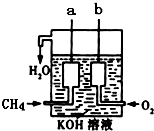 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是: