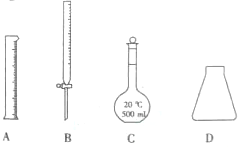
题目内容
14.下列化合物中不能使酸性高锰酸钾溶液褪色的是( )| A. |  | B. | CH2═CHCH2OH | C. |  |
分析 含有碳碳不饱和键、醛基、连接苯环的碳原子上含有氢原子的苯的同系物都能被酸性高锰酸钾溶液氧化,据此分析解答.
解答 解:A.甲苯中连接苯环的碳原子上含有氢原子,所以能被酸性高锰酸钾溶液氧化生成苯甲酸而使酸性高锰酸钾溶液褪色,故A不选;
B.该物质中含有碳碳双键和醇羟基,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故B不选;
C.该物质中不含碳碳不饱和键,不能被酸性高锰酸钾溶液氧化,所以不能使酸性高锰酸钾溶液褪色,故C选;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃、醇和苯的同系物的性质,注意:并不是所有的苯的同系物都能被酸性高锰酸钾溶液氧化,为易错点.

练习册系列答案
相关题目
4.下列关于物质的分类或变化说法正确的是( )
| A. | 稀硫酸、NaCl溶液是实验室常见的强电解质 | |
| B. | 二氧化氮经加压凝成无色液体为物理变化 | |
| C. | Na2O•SiO2是一种简单的硅酸盐,可溶于水 | |
| D. | 溴水滴入植物油中振荡褪色,说明溴被植物油从溴水中萃取出来 |
5.若要在铁片上镀铜,下列叙述中正确的是( )
①将铁片接在电源的正极 ②将铜片接在电源的正极 ③在铁片上发生的反应是Cu2++2e-═Cu ④在铜片上发生的反应是4OH--4e-═2H2O+O2↑ ⑤可用含Fe2+的溶液作电镀液 ⑥可用含Cu2+的溶液作电镀液.
①将铁片接在电源的正极 ②将铜片接在电源的正极 ③在铁片上发生的反应是Cu2++2e-═Cu ④在铜片上发生的反应是4OH--4e-═2H2O+O2↑ ⑤可用含Fe2+的溶液作电镀液 ⑥可用含Cu2+的溶液作电镀液.
| A. | ①③⑥ | B. | ②③⑥ | C. | ①④⑤ | D. | ②③④ |
2.下列关于胶体的叙述正确的是( )
| A. | 将含0.001 mol FeCl3的溶液全部滴到沸水中,可形成0.001 mol Fe(OH)3胶体粒子 | |
| B. | 胶体可以透过半透膜 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 直径介于1 nm~100 nm之间的微粒称为胶体 |
19.常温下,pH相同且都等于2的盐酸和醋酸,各取20mL,则下列说法正确的是( )
| A. | 将两种溶液都稀释100倍,醋酸的pH大于盐酸 | |
| B. | 用相同浓度的氢氧化钠溶液中和,消耗氢氧化钠的体积相等 | |
| C. | 分别加入质量相同的足量锌粉,开始时盐酸反应速率快 | |
| D. | 盐酸的浓度为0.01mol•L-1,醋酸浓度大于0.01mol•L-1 |
6.有关盐类水解的说法不正确的是( )
| A. | 盐类水解是酸碱中和反应的逆反应 | |
| B. | 盐类水解的结果使盐溶液不一定呈中性 | |
| C. | 盐类水解的结果使水的电离程度减小 | |
| D. | 盐类水解的结果使水的电离程度增大 |
3.化学与人类生产和生活密切相关,下列说法正确的是( )
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 加碘食盐中加入的I2有利于防止地方缺碘病 | |
| C. | 二氧化硫有漂白性,常用作棉、麻、纸张的漂白 | |
| D. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 |
5.如表是周期表的一部分,请回答有关问题.
(1)①原子结构示意图是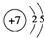 ,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.
,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.
(2)原子半径③>④,金属性③>④,(填“>”或“<”)
(3)②和⑦形成的化合物中,能使品红溶液腿色的是SO2(填化学式),它对环境的主要危害是形成酸雨,⑦、⑧元素形成的氢化物热稳定性较强的是HCl(填化学式).
(4)写出③与水反应的化学方程式2Na+2H2O═H2↑+2NaOH.
| ⅠA | ⅡA | ⅢA | Ⅳ | ⅤA | ⅥA | ⅦA | 0 | |
| 二周期 | ① | ② | | |||||
| 三周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
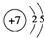 ,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.
,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.(2)原子半径③>④,金属性③>④,(填“>”或“<”)
(3)②和⑦形成的化合物中,能使品红溶液腿色的是SO2(填化学式),它对环境的主要危害是形成酸雨,⑦、⑧元素形成的氢化物热稳定性较强的是HCl(填化学式).
(4)写出③与水反应的化学方程式2Na+2H2O═H2↑+2NaOH.