题目内容
11.将4mol NaHCO3和2mol Na2O2固体混合,在加热条件下使其充分反应,则所得固体的物质的量为( )| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
分析 混合物加热发生发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +H2O+CO2↑、2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4NaOH+O2↑,4molNaHCO3分解生成2molNa2CO3、2molH2O和2molCO2,过氧化钠与水、二氧化碳混合物反应,可认为先与二氧化碳反应,再与水反应,据此计算.
解答 解:混合物加热发生发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +H2O+CO2↑、2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4NaOH+O2↑,4molNaHCO3分解生成2molNa2CO3、2molH2O和2molCO2,2mol二氧化碳恰好与2mol过氧化钠反应生成2mol碳酸钠固体,所以得到固体的物质的量为4mol,
故选:D.
点评 本题考查了有关方程式的计算,明确碳酸氢钠、过氧化钠的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
1.25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
| A. | 均存在电离平衡和水解平衡 | |
| B. | 存在的粒子种类不相同 | |
| C. | c(OH-)前者小于后者 | |
| D. | 分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
2.下列关于胶体的叙述正确的是( )
| A. | 将含0.001 mol FeCl3的溶液全部滴到沸水中,可形成0.001 mol Fe(OH)3胶体粒子 | |
| B. | 胶体可以透过半透膜 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 直径介于1 nm~100 nm之间的微粒称为胶体 |
19.常温下,pH相同且都等于2的盐酸和醋酸,各取20mL,则下列说法正确的是( )
| A. | 将两种溶液都稀释100倍,醋酸的pH大于盐酸 | |
| B. | 用相同浓度的氢氧化钠溶液中和,消耗氢氧化钠的体积相等 | |
| C. | 分别加入质量相同的足量锌粉,开始时盐酸反应速率快 | |
| D. | 盐酸的浓度为0.01mol•L-1,醋酸浓度大于0.01mol•L-1 |
6.有关盐类水解的说法不正确的是( )
| A. | 盐类水解是酸碱中和反应的逆反应 | |
| B. | 盐类水解的结果使盐溶液不一定呈中性 | |
| C. | 盐类水解的结果使水的电离程度减小 | |
| D. | 盐类水解的结果使水的电离程度增大 |
3.化学与人类生产和生活密切相关,下列说法正确的是( )
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | 加碘食盐中加入的I2有利于防止地方缺碘病 | |
| C. | 二氧化硫有漂白性,常用作棉、麻、纸张的漂白 | |
| D. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 |
1. 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:
(1)如果将4mol NH3 和5mol O2放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3的转化率为80%.
4NH2(g)+5O2(g)?4NO(g)+6H2O(g)△H=-akJ•mol-1(a>0)
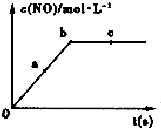
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a 正)、v(b 逆)、v(c 正)的大小关系是v(a正)>v(b逆)=v(c正).
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如表:
①第2min 到第4min,反应速率v(O2)=0.75mol/(L.min);
②第2min 时改变了条件,改变的条件可能是D(从所给选项中选择);
A.降低温度 B.增加了生成物 C.减小压强 D.使用了高效催化剂
③在与第4min 相同的温度下,若起始向容器中加入NH3、O2、NO 和H2O(g)的浓度都为2moI/L,则该反应正反应方向进行(填“正反应方向进行”、“逆反应方向进行”、“不移动”).
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为CO(NH2)2+NO+NO2$\frac{\underline{\;70-95℃\;}}{\;}$N2+CO2+2H2O.
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kj•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kj•mol-1
则1mol 甲烷直接将NO2 还原为N2的焓变为△H=-867kJ•mol-1.
 氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位、工业制硝酸的主要反应之一是:(1)如果将4mol NH3 和5mol O2放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3的转化率为80%.
4NH2(g)+5O2(g)?4NO(g)+6H2O(g)△H=-akJ•mol-1(a>0)
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a 正)、v(b 逆)、v(c 正)的大小关系是v(a正)>v(b逆)=v(c正).
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如表:
| 深度/mol•L-1 时间/min | C(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | 4.5 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
②第2min 时改变了条件,改变的条件可能是D(从所给选项中选择);
A.降低温度 B.增加了生成物 C.减小压强 D.使用了高效催化剂
③在与第4min 相同的温度下,若起始向容器中加入NH3、O2、NO 和H2O(g)的浓度都为2moI/L,则该反应正反应方向进行(填“正反应方向进行”、“逆反应方向进行”、“不移动”).
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为CO(NH2)2+NO+NO2$\frac{\underline{\;70-95℃\;}}{\;}$N2+CO2+2H2O.
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kj•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kj•mol-1
则1mol 甲烷直接将NO2 还原为N2的焓变为△H=-867kJ•mol-1.
2.常温下,下列事实可证明氨水是弱碱的是( )
| A. | 氨水能跟氯化铁溶液反应生成氢氧化铁 | |
| B. | 铵盐受热易分解 | |
| C. | 0.1 mol/L氯化铵溶液的pH约为5 | |
| D. | 0.1 mol/L氨水可使酚酞试液变红 |