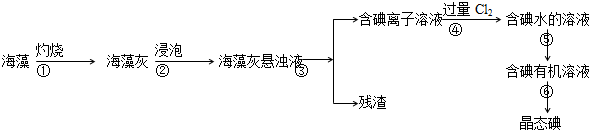
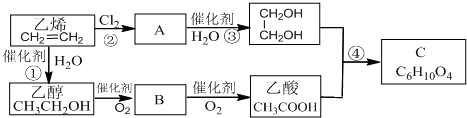
题目内容
13. 短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常温下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物民其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.
短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常温下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物民其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.(1)已知相关物质之间存在如下变化:
①丁与乙和水反应生成戊和丙的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,由物质已电解得到单质D的化学方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
②0.1mol/L的丙溶液中所含离子浓度由大到小排列顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-);常温下,为使丙溶液中由丙电离的阴、阳离子浓度相等,应向溶液中加入一定量的乙的水溶液至溶液pH=7.
(2)已知E 及其化合物有以下变化:

写出单质E与化合物Z在一定条件下反应生成X和水的化学方程式S+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O;由A、B、C、D、E5种元素中的两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为H2O2或N2H4或C2H6等(任写一个即可).
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的C的含氧酸盐的化学式是NaNO2.
分析 短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常压下是最轻的气体,A为H元素,B元素所形成化合物种类最多,B为C元素,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙,丙为铵盐,故C为N元素,甲为HNO3,乙为NH3,丙为NH4NO3,D元素的离子半径是同周期元素形成的简单离子中最小的,D的原子序数比N元素大,故D处于第三周期,为Al元素;结合转化可知丁为Al(NO3)3,戊为Al(OH)3,加热生成氧化铝,氧化铝电解生成Al.
(1)①丁与乙和水反应生成氢氧化铝和硝酸铵,电解氧化铝制备Al;
②硝酸铵溶液中铵根离子水解显酸性,可通入氨气抑制水解使pH=7;
(2)E元素原子序数大于Al,处于第三周期,由E$\stackrel{O_{2}}{→}$X$\stackrel{O_{2}}{→}$Y,E可能为S,X为SO2,Y为SO3,由Y$\stackrel{H_{2}O}{→}$Z,Z为H2SO4,硫酸与硫反应可以生成二氧化硫,符合转化关系;
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,该无色气体为NO.相同体积下体积之比等于物质的量之比,反应中只有N元素与O元素的化合价发生变化,利用电子转移守恒计算N元素在酸根中的化合价,判断酸根离子书写盐的化学式.
解答 解:短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常压下是最轻的气体,A为H元素,B元素所形成化合物种类最多,B为C元素,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙,丙为铵盐,故C为N元素,甲为HNO3,乙为NH3,丙为NH4NO3,D元素的离子半径是同周期元素形成的简单离子中最小的,D的原子序数比N元素大,故D处于第三周期,为Al元素;结合转化可知丁为Al(NO3)3,戊为Al(OH)3,加热生成氧化铝,氧化铝电解生成Al.
(1)①丁与乙和水反应生成氢氧化铝和硝酸铵,离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+;电解氧化铝制备Al,化学反应为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;
②硝酸铵溶液中铵根离子水解显酸性,离子浓度由大到小排列顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-),可通入氨气抑制水解时丙电离的阴、阳离子浓度相等,溶液pH=7,故答案为:c(NO3-)>c(NH4+)>c(H+)>c(OH-);溶液pH=7;
(2)E元素原子序数大于Al,处于第三周期,由E$\stackrel{O_{2}}{→}$X$\stackrel{O_{2}}{→}$Y,E可能为S,X为SO2,Y为SO3,由Y$\stackrel{H_{2}O}{→}$Z,Z为H2SO4,单质S与H2SO4在一定条件下反应生成SO2和水,反应的化学方程式为:S+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O;由H、C、N、Al、S 5种元素中的两种元素,形成既含极性键又含非极性键的18电子的分子,该分子为H2O2、N2H4、C2H6等;
故答案为:S+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O;H2O2或N2H4或C2H6等;
(3)该无色气体是NO,2LNO与0.5L的氧气混合,混合气体被足量的NaOH溶液完全吸收后没有气体残留,反应中只有N元素与O元素的化合价发生变化,令N元素在酸根中的化合价为a,根据电子转移守恒有2×(a-2)=0.5×4,解得a=3,即酸根中N元素的化合价为+3,故生成NaNO2,故答案为:NaNO2.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应、反应原理为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

 目标测试系列答案
目标测试系列答案| A. | 有四瓶失去标签的溶液,知道他们是乙醛、乙酸、乙醇和甲酸,用新制的Cu(OH)2悬浊液可以将四种溶液一一鉴别 | |
| B. | 已知苹果酸的结构简式为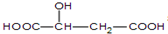 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 | |
| C. | 按系统命名法,化合物 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| D. | 等物质的量的乙炔、乙醛、(HO)CH2-CH2(OH)完全燃烧时的耗氧量不相等 |
| A. | 油脂、淀粉、麦芽糖和蛋白质在一定条件都能发生水解反应 | |
| B. | 甲烷和苯都不能与溴水、酸性高锰酸钾溶液发生反应,但苯不属于饱和烃 | |
| C. | 将红热的铜丝迅速插入乙醇中,可观察到铜丝表面变红 | |
| D. | 苯、甲苯、二甲苯等有机物可通过煤的液化、气化后分离获得 |
| A. | 物质的分离提纯方法之一为“筛分”:如胶体-渗析法提纯;悬浊液-过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” | |
| B. | 酸式滴定管,碱式滴定管、移液管都是准确量取一定体积液体的仪器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程 | |
| C. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3次的实验平均值等措施,已达到良好的实验结果 | |
| D. | 将适量植物油、酒精和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可以制得肥皂 |
| A. | 明矾溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| B. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| C. | 医药中常用95%酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性 | |
| D. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 |
 .
. .
.