题目内容
13.以乙烯为原料合成化合物C的流程如图所示: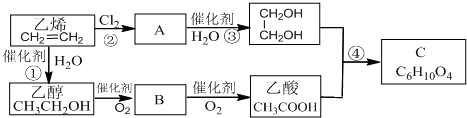
(1)请写出B和C中含有的官能团名称分别为:醛基,酯基.
(2)写出A的结构简式CH2ClCH2Cl.
(3)①③的反应类型分别为加成反应和取代反应.
(4))写出反应②和④的化学方程式:②2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O; ④2CH3COOH+HOCH2-CH2OH$?_{△}^{浓硫酸}$CH3COOCH2-CH2OOCCH3+2H2O.
分析 由流程图可知:乙烯与氯气发生加成反应生成物质A,则A为:1,2-二氯乙烷,1,2-二氯乙烷水解生成乙二醇;乙烯与水反应生成乙醇,乙醇发生催化氧化得到物质B,则B为乙醛,乙醛催化氧化得到乙酸;乙酸与乙二醇在浓硫酸条件下发生酯化反应生成二乙酸乙二酯,以此解答该题.
解答 解:乙烯与氯气发生加成反应生成物质A,则A为:1,2-二氯乙烷,1,2-二氯乙烷水解生成乙二醇;乙烯与水反应生成乙醇,乙醇发生催化氧化得到物质B,则B为乙醛,乙醛催化氧化得到乙酸;乙酸与乙二醇在浓硫酸条件下发生酯化反应生成二乙酸乙二酯,
(1)B为乙醛,含有醛基,C为二乙酸乙二酯,含有酯基,故答案为:醛基;酯基;
(2)由以上分析可知A为CH2ClCH2Cl,故答案为:CH2ClCH2Cl;
(3)由合成流程图可知,反应①为乙烯与水的加成反应,反应③为卤代烃的水解生成醇,水解反应为取代反应,故答案为:加成反应;取代反应;
(4)反应②为乙烯与氯气发生加成反应,化学方程式为CH2=CH2+Cl2$→_{△}^{Cu}$CH2ClCH2Cl,
反应④为2CH3COOH+HOCH2-CH2OH$?_{△}^{浓硫酸}$CH3COOCH2-CH2OOCCH3+2 H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;2CH3COOH+HOCH2-CH2OH$?_{△}^{浓硫酸}$CH3COOCH2-CH2OOCCH3+2H2O.
点评 本题考查有机推断题,题目难度中等,涉及官能团名称、物质的结构简式的书写、化学反应的类型判断、化学方程式的书写等知识,熟悉各种物质的结构和性质是解题关键,试题知识点较多,充分考查了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
4.已知氮的氧化物是严重的大气污染物,可以通过以下方法处理:
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ/mol
则反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)△K=-571kJ/mol
(2)在一定温度下,向体积1L的密闭容器中充入2molNO,10min时反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)达到平衡状态,反应过程中反应物浓度随时间的变化如图1所示.
①该反应的平衡常数K的计算式为$\frac{(0.4)^{2}×0.2}{(1.6)^{2}×(0.6)^{2}}$(mol.L)-1,千10min内N2平均反应速率v(N2)0.02mol/(L•min)
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,则此时:v正=v逆(天“>”、“>”或“=”)
③若保持其条件不变,15min时压缩容器至0.5L时反应重新达到平衡,NO的浓度对应的点应是图1中的B(填字母)
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2所示,若不适用CO,纬度超过775K,发现NO的分解率降低,其可能的原因是NO的分解反应为放热反应,升高温度有利于反应逆向进行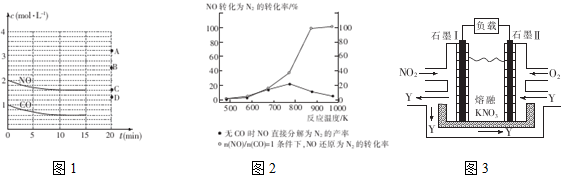
Ⅱ.利用电化学原理,将NO2、O2和熔融KNO3制 成燃料电池,其原理如图3,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅱ是电池的正极,石墨Ⅰ附近发生的反应电极反应式为NO2-e-+NO3-═N2O5相同条件下,消耗的O2和 NO2的体积比为1:4.
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ/mol
| 化学犍 | O=O | C=0 | C≡O |
| 键能(kJ/mol) | 497 | 803 | 1072 |
(2)在一定温度下,向体积1L的密闭容器中充入2molNO,10min时反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)达到平衡状态,反应过程中反应物浓度随时间的变化如图1所示.
①该反应的平衡常数K的计算式为$\frac{(0.4)^{2}×0.2}{(1.6)^{2}×(0.6)^{2}}$(mol.L)-1,千10min内N2平均反应速率v(N2)0.02mol/(L•min)
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,则此时:v正=v逆(天“>”、“>”或“=”)
③若保持其条件不变,15min时压缩容器至0.5L时反应重新达到平衡,NO的浓度对应的点应是图1中的B(填字母)
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2所示,若不适用CO,纬度超过775K,发现NO的分解率降低,其可能的原因是NO的分解反应为放热反应,升高温度有利于反应逆向进行

Ⅱ.利用电化学原理,将NO2、O2和熔融KNO3制 成燃料电池,其原理如图3,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅱ是电池的正极,石墨Ⅰ附近发生的反应电极反应式为NO2-e-+NO3-═N2O5相同条件下,消耗的O2和 NO2的体积比为1:4.
1. 二氧化碳的晶胞如图,每8个CO2构成立方体,且在6个面的中心各有1个,在每个CO2周围距离为$\frac{\sqrt{2}}{2}$a(其中a为立方体棱长)的CO2有( )
二氧化碳的晶胞如图,每8个CO2构成立方体,且在6个面的中心各有1个,在每个CO2周围距离为$\frac{\sqrt{2}}{2}$a(其中a为立方体棱长)的CO2有( )
 二氧化碳的晶胞如图,每8个CO2构成立方体,且在6个面的中心各有1个,在每个CO2周围距离为$\frac{\sqrt{2}}{2}$a(其中a为立方体棱长)的CO2有( )
二氧化碳的晶胞如图,每8个CO2构成立方体,且在6个面的中心各有1个,在每个CO2周围距离为$\frac{\sqrt{2}}{2}$a(其中a为立方体棱长)的CO2有( )| A. | 4个 | B. | 8个 | C. | 12个 | D. | 6个 |
8.四联苯 的一氯代物有( )
的一氯代物有( )
 的一氯代物有( )
的一氯代物有( )| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
5.下列关于胶体和溶液区别的叙述中,正确的是( )
| A. | 溶液呈电中性,胶体带有电荷 | |
| B. | 溶液中溶质粒子一定不带电,胶体中分散质粒子带有电荷 | |
| C. | 溶液中溶质粒子的运动有规律,而胶体粒子的运动无规律 | |
| D. | 溶液中通过一束光线时无特殊现象,胶体中通过一束光线时有明显的光带 |
2.下列叙述正确的是( )
| A. | 由分子组成的物质中不一定存在共价键 | |
| B. | 金刚石、石墨、足球烯均是碳元素的同素异形体,性质都相似 | |
| C. | 由非金属元素组成的晶体一定是分子晶体 | |
| D. | 仅由非金属元素组成的物质不可能含有离子键 |
3.下列实验中,利用了盐酸的氧化性的是( )
| A. | 用盐酸除去铜粉中混有的铁粉 | |
| B. | 用浓盐酸和MnO2制氯气 | |
| C. | 用盐酸跟氢氧化钠溶液反应 | |
| D. | 盐酸和硝酸银溶液反应生成白色沉淀 |
 短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常温下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物民其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.
短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常温下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物民其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.