题目内容
4.下列有关有机化学说法正确的是( )| A. | 有四瓶失去标签的溶液,知道他们是乙醛、乙酸、乙醇和甲酸,用新制的Cu(OH)2悬浊液可以将四种溶液一一鉴别 | |
| B. | 已知苹果酸的结构简式为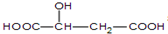 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 | |
| C. | 按系统命名法,化合物 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| D. | 等物质的量的乙炔、乙醛、(HO)CH2-CH2(OH)完全燃烧时的耗氧量不相等 |
分析 A.乙酸含-COOH,乙醛含-CHO,甲酸含-CHO和-COOH;
B.含-OH、-COOH,结合醇、羧酸的性质分析,且两个结构简式相同;
C.取代基的位次之和应最小;
D.均为1molCxHyOz时,乙炔、乙醛、(HO)CH2-CH2(OH)完全燃烧时的耗氧量为1mol×(x+$\frac{y}{4}$-$\frac{z}{2}$).
解答 解:A.乙醛在加热条件下与新制的Cu(OH)2悬浊液生成砖红色沉淀,乙酸使新制Cu(OH)2悬浊液溶解,乙醇遇新制Cu(OH)2悬浊液无明显现象,甲酸使新制Cu(OH)2悬浊液溶解、加热条件下能生成砖红色沉淀,现象不同可鉴别,故A正确;
B.两个结构简式是一样的,为同一种物质,含-OH可发生氧化、酯化反应,含-OH、-COOH可发生缩聚反应,故B错误;
C.有机物命名时应遵循:长、多、近、简、小原则,正确的名称为2,2,4,5-四甲基-3,3-二乙基己烷,故C错误;
D均为1molCxHyOz时,乙炔、乙醛、(HO)CH2-CH2(OH)完全燃烧时的耗氧量为1mol×(x+$\frac{y}{4}$-$\frac{z}{2}$)=2.5mol,即三者完全燃烧时与O2均以1:2.5反应,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、发生的反应等为解答的关键,侧重分析与应用能力的考查,注意有机反应的判断,题目难度不大.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 离子键是阴阳离子之间的静电引力 | |
| B. | 只有原子才满足核内质子数和核外电子数相等 | |
| C. | 离子化合物中一定有金属元素 | |
| D. | 氕、氘、氚互为氢元索的同位素,H2O、D2O和T2O是不同的分子 |
15.下列有关说法错误的是( )
| A. | 用BaCl2溶液鉴别SO42- 和 SO32- | |
| B. | 用浓HNO3与Cu 反应制备NO2 | |
| C. | 用特殊方法把固体物质加工到纳米级(1nm-100nm) 的超细粉末粒子,制得纳米材料,纳米材料也是一种胶体 | |
| D. | 将混有HCl的Cl2通入饱和NaCl溶液中除去HCl |
12.下列反应中,属于加成反应的是( )
| A. | CH2=CH2+HOCl→HOCH2-CH2Cl | |
| B. |  +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$ +H2O +H2O | |
| C. | 2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O | |
| D. | C12H22O11+H2O $→_{△}^{稀H_{2}SO_{4}}$ C6H12O6+C6H12O6 蔗糖 葡萄糖 果糖 |
19.试管中盛有少量白色固体,可能是铵盐,检验的方法是( )
| A. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| B. | 加水,将湿润的红色石蕊试纸放在试管口 | |
| C. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 |
9.下列各组化学式表示分子的是( )
| A. | NaCl、H2O、CO2、H2S | B. | Ne、NH3、P2O5、H2SO4 | ||
| C. | Na2SO4、NH4NO3、PH3、H2S | D. | Si、S、SO2、CO |
4.已知氮的氧化物是严重的大气污染物,可以通过以下方法处理:
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ/mol
则反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)△K=-571kJ/mol
(2)在一定温度下,向体积1L的密闭容器中充入2molNO,10min时反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)达到平衡状态,反应过程中反应物浓度随时间的变化如图1所示.
①该反应的平衡常数K的计算式为$\frac{(0.4)^{2}×0.2}{(1.6)^{2}×(0.6)^{2}}$(mol.L)-1,千10min内N2平均反应速率v(N2)0.02mol/(L•min)
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,则此时:v正=v逆(天“>”、“>”或“=”)
③若保持其条件不变,15min时压缩容器至0.5L时反应重新达到平衡,NO的浓度对应的点应是图1中的B(填字母)
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2所示,若不适用CO,纬度超过775K,发现NO的分解率降低,其可能的原因是NO的分解反应为放热反应,升高温度有利于反应逆向进行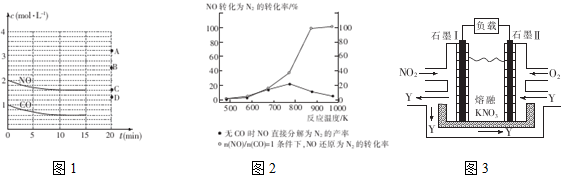
Ⅱ.利用电化学原理,将NO2、O2和熔融KNO3制 成燃料电池,其原理如图3,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅱ是电池的正极,石墨Ⅰ附近发生的反应电极反应式为NO2-e-+NO3-═N2O5相同条件下,消耗的O2和 NO2的体积比为1:4.
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ/mol
| 化学犍 | O=O | C=0 | C≡O |
| 键能(kJ/mol) | 497 | 803 | 1072 |
(2)在一定温度下,向体积1L的密闭容器中充入2molNO,10min时反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)达到平衡状态,反应过程中反应物浓度随时间的变化如图1所示.
①该反应的平衡常数K的计算式为$\frac{(0.4)^{2}×0.2}{(1.6)^{2}×(0.6)^{2}}$(mol.L)-1,千10min内N2平均反应速率v(N2)0.02mol/(L•min)
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,则此时:v正=v逆(天“>”、“>”或“=”)
③若保持其条件不变,15min时压缩容器至0.5L时反应重新达到平衡,NO的浓度对应的点应是图1中的B(填字母)
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2所示,若不适用CO,纬度超过775K,发现NO的分解率降低,其可能的原因是NO的分解反应为放热反应,升高温度有利于反应逆向进行

Ⅱ.利用电化学原理,将NO2、O2和熔融KNO3制 成燃料电池,其原理如图3,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅱ是电池的正极,石墨Ⅰ附近发生的反应电极反应式为NO2-e-+NO3-═N2O5相同条件下,消耗的O2和 NO2的体积比为1:4.
 .
. 短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常温下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物民其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.
短周期主族元素A、B、C、D、E,原子序数依次增大,A元素的单质常温常温下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物民其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.