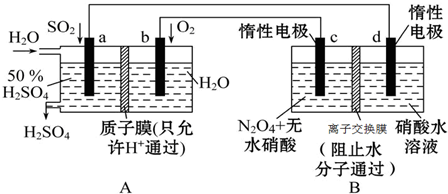
题目内容
12.依据氧化还原反应:Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu (s)设计的原电池如图所示.请回答下列问题:
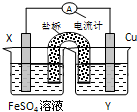
(1)电极X的材料是Fe;电解质溶液Y是CuSO4溶液;
(2)Cu电极为电池的正极,发生的电极反应为Cu2++2e-═CuX电极上发生的电极反应为Fe-2e-═Fe2+;
(3)外电路中的电流是从Cu电极流向Fe电极.
分析 根据反应“Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu (s)”分析,在反应中,Fe被氧化,失电子,应为原电池的负极,正极为活泼性较Fe弱的Cu,Cu2+在正极上得电子被还原,电解质溶液为CuSO4溶液,原电池中,电流从正极经外电路流向负极,由此分析解答.
解答 解:(1)含有盐桥的原电池中,电极材料和相对应的电解质溶液具有相同的金属元素,所以X电极材料为Fe,Y电解质溶液为CuSO4溶液,
故答案为:Fe;CuSO4溶液;
(2)根据电池反应式知,Fe元素化合价由0价变为+2价,则Fe作负极,所以Cu作正极,正极Cu电极反应式为Cu2++2e-=Cu、负极反应式为 Fe-2e-=Fe2+,
故答案为:正;Cu2++2e-=Cu; Fe-2e-=Fe2+;
(3)放电时,电流从正极流向负极,即从Cu电极流向Fe电极,故答案为:Cu;Fe.
点评 本题考查了原电池原理,明确原电池中元素化合价升降与正负极的关系是解本题关键,再结合电子移动方向分析解答,题目难度不大.

练习册系列答案
相关题目
2.控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列判断正确的是( )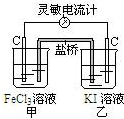

| A. | 反应开始时,乙中石墨电极上发生还原反应 | |
| B. | 反应开始时,甲中石墨电极上Fe3+被氧化 | |
| C. | 盐桥中的K+向乙中迁移,Cl-向甲中迁移 | |
| D. | 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为正极 |
20.下列说法正确的是( )
| A. | 用镀锡铁做罐头盒,当镀层破坏后锡能对铁提供保护 | |
| B. | 用铜作电极电解稀硫酸,发生反应:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 某原电池的电极材料分别为Mg和Al,则Mg一定做负极 | |
| D. | 某可逆反应升高温度,活化能大的方向化学反应速率增大程度小 |
7.某烷烃的结构为其一 氯取代物有几种( )
氯取代物有几种( )
 氯取代物有几种( )
氯取代物有几种( )| A. | 4 | B. | 5 | C. | 3 | D. | 6 |
17.将下列液体分别与溴水混合并振荡,静置后分为两层,溴水层几乎呈无色的是( )
| A. | 氯水 | B. | 乙烯 | C. | 乙醇 | D. | 碘化钾溶液 |
1.PbO2、KMnO4、C12、FeC13、CuC12的氧化性依次减弱.下列反应在水溶液中不可能发生的是( )
| A. | Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 1OCI-+2MnO4一+16H+═2Mn2++5Cl2↑+8H2O | |
| C. | 2Cu+C12$\frac{\underline{\;点燃\;}}{\;}$2CuC12 | |
| D. | 5Pb2++2MnO4一+2H2O═5PbO2+2Mn2++4H+ |
2.在含有大量Ba2+、Fe3+、NO3-的溶液中,还可能大量存在的离子是( )
| A. | OH- | B. | H+ | C. | SO42- | D. | SCN- |