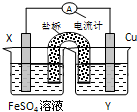
题目内容
4.膜技术原理在化工生产中有着广泛的应用.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如图.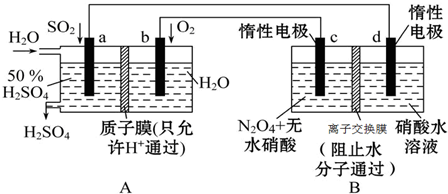
(1)A装置是原电池. (填“原电池”或“电解池”).
(2)N2O5在B池的c极(填“c极”或“d极”)区生成,其电极反应式为N2O4+2HNO3-2e-═2N2O5+2H+.
(3)A装置中通入O2一极的电极反应式为O2+4H++4e-═2H2O.
(4)若A装置中通入SO2的速率为2.24L•min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为13.6mL•min-1.
分析 (1)A装置能自发的进行氧化还原反应且没有外接电源;
(2)与电源的正极相连的电极为阳极,N2O4在阳极失电子生成N2O5;
(3)通入O2一极是原电池的正极,氧气得电子生成水;
(4)电池的负极反应式为:SO2-2e-+2H2O=4H++SO42-,根据方程式计算,注意硫酸的浓度不变.
解答 解:(1)A装置能自发的进行氧化还原反应且没有外接电源,所以是原电池,
故答案为:原电池;
(2)与电源的正极相连的电极为阳极,c极与正极相连为阳极,N2O4在阳极失电子生成N2O5,电极反应式为:N2O4+2HNO3-2e-═2N2O5+2H+;
故答案为:c极;N2O4+2HNO3-2e-═2N2O5+2H+;
(3)通入O2一极是原电池的正极,电极反应式为:O2-4e-+4H+=2H2O,故答案为:O2-4e-+4H+=2H2O;
(4)电池的负极反应式为:SO2-2e-+2H2O=4H++SO42-,1min内n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,消耗水0.2mol,生成硫酸的质量为:0.1mol×98g/mol=9.8g,消耗水的质量为:0.2mol×18g/mol=3.6g,向右侧正极区定向移动0.2mol,即0.2g H+,
设1min内通入xmLH2O,
则有:$\frac{9.8g}{9.8g+x×1g/mol-3.6g-0.2g}$×100%=50%
x=13.6mL/min,
故答案为:13.6.
点评 本题考查了原电池和电解池原理,根据是否自发进行判断原电池和电解池,再结合各个电极上发生的电极反应分析解答,难点是电极反应式的书写,题目难度中等,侧重于考查学的分析能力和计算能力.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | Fe在少量Cl2中燃烧生成FeCl2 | |
| B. | 石油的裂解、煤的干馏都是化学变化 | |
| C. | 化学反应的焓变与反应的途径有关 | |
| D. | 等质量的铜按a、b两种途径完全转化为硝酸铜,途径a、b消耗的硝酸一样多 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2;途径b:Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
15.下列说法正确的是( )
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 原电池阳极发生氧化反应 | |
| C. | 电解池阴极发生还原反应 | |
| D. | 电解池的阴极连接电源正极 |
19.下列关于0.5mol•L-1Al2(SO4)3溶液的叙述中,不正确的是( )
| A. | Al3+与SO42-的物质的量浓度之比为2:3 | |
| B. | 1L溶液中SO42-的物质的量为1.5mol | |
| C. | 准确称取17.1g的Al2(SO4)3用100 mL蒸馏水溶解可配制得到该浓度的溶液 | |
| D. | 从1L 0.5 mol•L-1Al2(SO4)3溶液中取出100mL,Al3+浓度仍为1 mol•L-1 |
9.钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用.完成下列计算:
(1)叠氮化钠(NaN3)受撞击完成分解产生钠和氮气,故可应用于汽车安全气囊.若产生40,.32L(标准状况下)氮气,至少需要叠氮化钠78g.
(2)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
①计算溶液中氢氧根离子的物质的量浓度0.75mol/L(忽略溶液体积变化).
②计算并确定该钠-钾合金的化学式NaK2
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O
已知通入二氧化碳336L(标准状况下),生成24mol Al(OH)3和15mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量之比为4:5
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠.通过计算,分析和比较上表3组数据,给出结论实验①所取氢氧化钠样品是NaOH、实验②和实验③所取氢氧化钠样品应该是NaOH•H2O.
(1)叠氮化钠(NaN3)受撞击完成分解产生钠和氮气,故可应用于汽车安全气囊.若产生40,.32L(标准状况下)氮气,至少需要叠氮化钠78g.
(2)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
①计算溶液中氢氧根离子的物质的量浓度0.75mol/L(忽略溶液体积变化).
②计算并确定该钠-钾合金的化学式NaK2
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O
已知通入二氧化碳336L(标准状况下),生成24mol Al(OH)3和15mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量之比为4:5
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
16.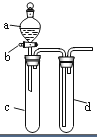 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是检查装置的气密性.
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是丙.
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3,则分液漏斗a中加入的试剂是稀盐酸,c中加入的试剂是大理石(或Na2CO3固体),d中加入的试剂是Na2SiO3溶液;实验现象为c中有气泡产生,d中生成白色胶状物质(或白色沉淀).但此实验存在不足之处,改进的措施是在c、d之间连接一个盛有饱和NaHCO3溶液的洗气瓶.
 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是检查装置的气密性.
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3,则分液漏斗a中加入的试剂是稀盐酸,c中加入的试剂是大理石(或Na2CO3固体),d中加入的试剂是Na2SiO3溶液;实验现象为c中有气泡产生,d中生成白色胶状物质(或白色沉淀).但此实验存在不足之处,改进的措施是在c、d之间连接一个盛有饱和NaHCO3溶液的洗气瓶.
13.下列有关离子的检验方法和判断正确的是( )
| A. | 向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- | |
| B. | 向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ | |
| C. | 向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ | |
| D. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色,说明原溶液中不含K+ |
14.A、B、C、D为四种短周期主族元素,且原子序数依次增大.已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子.下列说法正确的是( )
| A. | 原子半径:C>A | |
| B. | 气态氢化物的稳定性:A>B | |
| C. | 最髙价氧化物对应水化物的碱性:C<D | |
| D. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 |