题目内容
3.现有部分短周期元素的性质与原子(或分子)结构如下表:| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
 ;
;(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号);
a.Y单质的熔点比Z单质低b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式Na2O2,并写出该化合物与水反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素T和氢元素形成的化合物属于共价化合物,元素Z与元素T形成的化合物属于离子化合物(以上两空选填“共价化合物”或“离子化合物”).
分析 短周期元素中,T元素原子最外层电子数是次外层电子数的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故T为O元素;常温下X单质为双原子分子,分子中含有3对共用电子对,则X为N元素;Y元素原子的M层比K层少1个电子,则Y为Na;Z是第3周期元素的简单离子中半径最小,则Z为Al.
解答 解:短周期元素中,T元素原子最外层电子数是次外层电子数的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故T为O元素;常温下X单质为双原子分子,分子中含有3对共用电子对,则X为N元素;Y元素原子的M层比K层少1个电子,则Y为Na;Z是第3周期元素的简单离子中半径最小,则Z为Al.
(1)T为O元素,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)同周期自左而右金属性减弱,故金属性Na>Al,
a.单质的熔点属于物理性质,不能比较金属性强弱,故a错误;
b.金属性强弱与化合价无关,与失去电子难易程度有关,故b错误;
c.金属性单质与水反应越剧烈,说明金属性越强,故c正确;
d.金属性越强,最高价氧化物的水化物的碱性越强,故d正确,
故答案为:Na;cd;
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物为Na2O2,该化合物与水反应的化学方程式:2Na2O2+2H2O═4NaOH+O2↑,
故答案为:Na2O2;2Na2O2+2H2O═4NaOH+O2↑;
(4)元素T和氢元素形成的化合物为水、过氧化氢,属于共价化合物,元素Z与元素T形成的化合物为氧化铝,属于离子化合物,
故答案为:共价化合物;离子化合物.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意金属性、非金属性强弱比较实验事实,难度不大.

练习册系列答案
相关题目
13.已知硅在自然界中有3种同位素:${\;}_{14}^{28}Si$、${\;}_{14}^{29}$Si、${\;}_{14}^{30}Si$.硅的近似相对原子质量为28.1,则${\;}_{14}^{28}Si$原子在自然界中的百分含量为( )
| A. | 等于90% | B. | 大于90% | C. | 小于90% | D. | 无法判断 |
14.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这种碳原子称为“手性碳原子”,凡有一个手性碳原子的物质一定具有光学活性,如图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )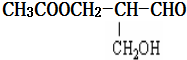
| A. | 与甲酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 在铜作催化剂与氧气加热反应 | D. | 在催化剂存在下与氢气反应 |
11.电子表和电子计算器的电源通常用微型银-锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,电极总反应为:Ag2O+H2O+Zn=Zn(OH)2+2Ag.下列叙述正确的是( )
| A. | Zn是正极,Ag2O是负极 | |
| B. | 工作时电子由Zn极经溶液移向Ag2O极 | |
| C. | 该电池可将化学能100%转化为电能 | |
| D. | Zn是负极,反应为Zn-2 e-+2OH-=Zn(OH)2 |
8.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | F-离子结构示意图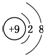 | ||
| C. | 次氯酸电子式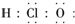 | D. | 用电子式表示HCl形成过程 |
15.某反应的△H=+100kJ•mol-1,下列有关该反应的叙述正确的是( )
| A. | 正反应活化能小于100 kJ•mol-1 | |
| B. | 逆反应活化能一定小于100 kJ•mol-1 | |
| C. | 正反应活化能不小于100 kJ•mol-1 | |
| D. | 正反应活化能比逆反应活化能小100 kJ•mol-1 |
12.25℃时,水的电离达到平衡:H2O?H++OH-;△H>0,下列叙述正确的是( )
| A. | 向水中加入少量固体KHSO4,c(H+)增大,KW不变 | |
| B. | 向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量NH4Cl固体,平衡正向移动,c(H+)降低 | |
| D. | 将水加热,KW增大,pH不变 |
15.电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板,有关反应方程式为2FeCl3+Cu=2FeCl2+CuCl2.
现将一块敷有铜箔的绝缘板浸入8.00×102mL 某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00mL,向其中滴入3.00mol•L-1AgNO3溶液60.00mL时,溶液中的Cl-恰好完全沉淀.计算:
(1)溶液A中FeCl3的物质的量浓度为3.00mol/L;
(2)假设铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于67.2g;
(3)讨论当剩余固体的组成不同时,m与n可能的取值范围,并填写下表相关栏目.
(4)当m=100.0,n=96.8时,溶液B中FeCl2的物质的量浓度为2.50 mol•L-1.
现将一块敷有铜箔的绝缘板浸入8.00×102mL 某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00mL,向其中滴入3.00mol•L-1AgNO3溶液60.00mL时,溶液中的Cl-恰好完全沉淀.计算:
(1)溶液A中FeCl3的物质的量浓度为3.00mol/L;
(2)假设铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于67.2g;
(3)讨论当剩余固体的组成不同时,m与n可能的取值范围,并填写下表相关栏目.
| 剩余固体的组成 | m的取值范围 | n的取值范围 |
| 只有铜 | ||
| 有铁和铜 | (用含m的代数式表示) |