题目内容
12.25℃时,水的电离达到平衡:H2O?H++OH-;△H>0,下列叙述正确的是( )| A. | 向水中加入少量固体KHSO4,c(H+)增大,KW不变 | |
| B. | 向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量NH4Cl固体,平衡正向移动,c(H+)降低 | |
| D. | 将水加热,KW增大,pH不变 |
分析 水的电离平衡:H2O?H++OH-中,要使平衡发生移动,应改变溶液c(H+)或c(OH-)的浓度,水的电离是吸热过程,升高温度,平衡向电离方向移动,K增大,c(H+),则pH减小.
解答 解:A、向水中加入少量固体KHSO4,硫酸氢钾电离出的氢离子抑制水的电离,平衡逆向移动,c(H+)增大,平衡常数只与温度有关,温度不变,水的离子积不变,故A正确;
B、向水中加入少量氢氧化钠溶液,抑制水电离,平衡逆向移动,但是c(OH-)增大,故B错误;
C、向水中加入少固体NH4Cl,铵根水解促进水的电离,平衡正向进行,c(H+)增大,故C错误;
D、水的电离是吸热过程,将水加热,促进水的电离,KW增大,氢离子浓度增大,pH减小,故D错误;
故选A.
点评 本题考查了水的电离平衡的影响因素分析和水的离子积的条件判断和计算应用,主要是抑制水的电离的溶液可以是酸也可以是碱溶液,题目较简单.

练习册系列答案
相关题目
2.下列物质属于纯净物的是( )
| A. | 汽油 | B. | 福尔马林 | C. | 冰醋酸 | D. | 聚氯乙烯 |
3.现有部分短周期元素的性质与原子(或分子)结构如下表:
(1)画出元素T的原子结构示意图 ;
;
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号);
a.Y单质的熔点比Z单质低b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式Na2O2,并写出该化合物与水反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素T和氢元素形成的化合物属于共价化合物,元素Z与元素T形成的化合物属于离子化合物(以上两空选填“共价化合物”或“离子化合物”).
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
 ;
;(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号);
a.Y单质的熔点比Z单质低b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式Na2O2,并写出该化合物与水反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素T和氢元素形成的化合物属于共价化合物,元素Z与元素T形成的化合物属于离子化合物(以上两空选填“共价化合物”或“离子化合物”).
17.下列对溶液叙述正确的是( )
| A. | 在中和滴定实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 | |
| B. | 用碱式滴定管量取25.00mL高锰酸钾溶液 | |
| C. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW |
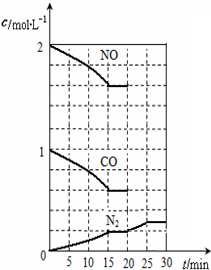 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法. ;
;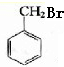 +H2O、
+H2O、 、
、 .
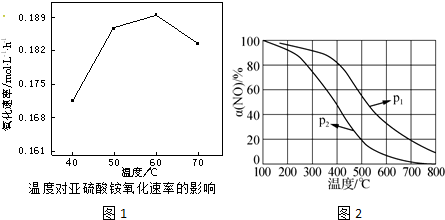
.
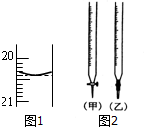 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题: