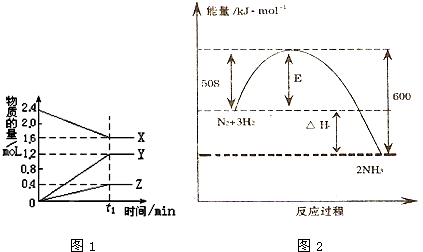
题目内容
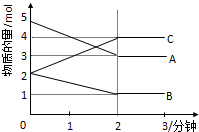 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示:
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示:(1)2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了
(2)用A、B、C表示出该反应的化学方程式:
(3)计算2分钟时A的转化率(写出具体计算过程)
考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法,化学平衡的计算
专题:化学平衡专题
分析:(1)当各物质的物质的量不再变化时,反应达到平衡状态,正逆反应速率相等,据此作判断;
(2)从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(3)根据转化率=
计算.
(2)从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(3)根据转化率=
| △n |
| n(总) |
解答:
解:(1)当反应达到平衡状态时,各物质的物质的量不再变化,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了平衡状态,此时正逆反应速率相等,故答案为:平衡状态,等于;
(2)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,作为C为生成物,
当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,
化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,
所以反应的化学方程式为:2A+B 2C,故答案为:2A+B
2C,故答案为:2A+B 2C;
2C;
(3)转化率=
=
=40%,
故答案为:40%.
(2)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,作为C为生成物,
当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,
化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,
所以反应的化学方程式为:2A+B
 2C,故答案为:2A+B
2C,故答案为:2A+B 2C;
2C;(3)转化率=
| △n |
| n(总) |
| 5mol-3mol |
| 5mol |
故答案为:40%.
点评:本题考查化学平衡图象问题,题目难度不大,注意把握由图象判断化学方程式的方法.

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
下列有关化学键与物质结构的说法正确的是( )
| A、两种元素组成的分子中一定只有极性键 |
| B、分子中的价电子对(包括成键电子对和孤电子对)之间存在相互排斥作用 |
| C、非金属元素组成的化合物一定是共价化合物 |
| D、含有阳离子的物质一定含有阴离子 |
下列说法不 正确的是( )
| A、取一小块金属钠,放在燃烧匙里加热,金属钠先熔化,燃烧时火焰为黄色,生成淡黄色固体物质 |
| B、除去NaHCO3溶液中的Na2CO3,应通入过量的CO2气体 |
| C、金属钠与CuSO4溶液反应时,既有沉淀析出,又有气体逸出 |
| D、铯与冷水反应十分剧烈并生成H2,铯的氧化物可直接与水反应生成Cs(OH)2 |
向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸,下列离子方程式与事实不符的是( )
| A、OH-+CO32-+2H+→HCO3-+H2O |
| B、2OH-+CO32-+3H+→HCO3-+2H2O |
| C、2OH-+CO32-+4H+→CO2↑+3H2O |
| D、OH-+CO32-+3H+→CO2↑+2H2O |
卤素间形成的化合物如“IF5、BrCl、IBr”等称为卤素互化物,化学性质与卤素单质类似,则下列关于卤素互化物的性质的描述及发生的相关反应不正确的是( )
| A、IF5+3H2O═HIO3+5HF |
| B、3IBr+2Fe═FeI3+FeBr3 |
| C、BrCl的氧化性强于I2 |
| D、IBr可以与NaOH溶液反应生成2种盐 |
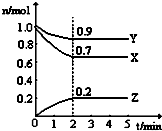 某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题: (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式: