题目内容
10. 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为 1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示,5分钟时反应停止.请依图回答下列问题:
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为 1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示,5分钟时反应停止.请依图回答下列问题:(1)放出一半气体所需要的时间为1min;
(2)A、B、C、D各点反应速率快慢的顺序是D>C>B>A.
分析 反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积,随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减小.
解答 解:(1)由图象可知,当时间进行到1min时,需要的时间为1min,故答案为:1 min;
(3)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,
故答案为:D>C>B>A.
点评 本题考查过氧化氢分解的速率曲线,题目难度不大,主要考查浓度对反应速率的影响,注意对图象的分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列物质中既含有离子键又含有共价键的是( )
| A. | Cl2 | B. | NaCl | C. | H2O | D. | NaOH |
1.化学反应进行的快慢可以用“化学反应速率”来衡量.在某一化学反应中,反应物B 的浓度在20s内从1.0mol•L-1变成0.2mol•L-1,则在这20s内以B物质表示的化学反应速率为( )
| A. | 0.08 mol•L-1•s-1 | B. | 0.04 mol•L-1•s-1 | ||
| C. | 0.8 mol•L-1•s-1 | D. | 0.04 mol•L-1 |
18.下列说法正确的是( )
| A. | 3≤原子最外层电子数<8的元素一定是非金属元素 | |
| B. | 原子最外层只有2个电子的元素一定是第ⅡA族元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定是第二周期元素 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
2.下列反应中,属于加成反应的是( )
| A. | 苯与液溴在FeBr3催化下生成溴苯 | |
| B. | 乙醇在铜做催化剂的条件下,被空气中的氧气氧化成乙醛 | |
| C. | 乙烯使溴水褪色 | |
| D. | 乙酸与乙醇反应生成乙酸乙酯 |
11.某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如图实验:由此可知原溶液中( )
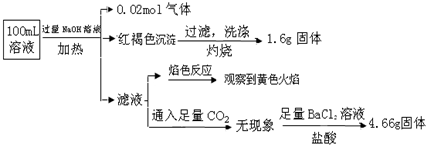

| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 取少量原溶液于试管中,加入KSCN溶液,溶液成血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
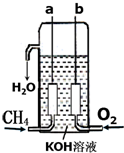 氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等.已知甲烷燃料电池的负极有碳酸根离子生成,请写出如图所构成的甲烷燃料电池中:a极的电极反应式:CH4+10OH--8e-=CO32-+7H2O,b极的电极反应式:O2+2H2O+4e-=4OH-,若将KOH溶液换为稀H2SO4,则a极的电极反应式:CH4+2H2O-8e-=CO2+8H+.
氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等.已知甲烷燃料电池的负极有碳酸根离子生成,请写出如图所构成的甲烷燃料电池中:a极的电极反应式:CH4+10OH--8e-=CO32-+7H2O,b极的电极反应式:O2+2H2O+4e-=4OH-,若将KOH溶液换为稀H2SO4,则a极的电极反应式:CH4+2H2O-8e-=CO2+8H+. +2H2O;
+2H2O;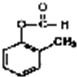 发生银镜反应的化学方程式:
发生银镜反应的化学方程式: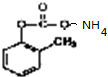 +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O; 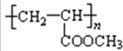 .
.