题目内容
 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题:(1)基态氮原子的价电子排布图为
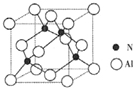
(2)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域.工业上用氮气与氧化铝和碳在一定条件下反应生成X和CO,X的晶体结构如图所示,工业制备X的化学方程式为
(3)X晶体中包含的化学键类型为
A.离子键 B.共价键 C.配位键 D.金属键
(4)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,可能的原因是
(5)若X的密度为p g/cm3,则晶体中最近的两个N原子的距离为
考点:晶胞的计算,原子核外电子排布,判断简单分子或离子的构型
专题:化学键与晶体结构
分析:(1)氮是7号元素,价电子数是5,价电子排布图为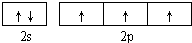 ,氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO
,氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO
,则其阳离子的化学式为:N
,其中心原子价电子对数为
=2,所以其中的氮原子按sp方式杂化,阳离子的构型为直线型,据此答题;
(2)根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子
×8+
×6=4,所以X的化学式为AlN,根据元素守恒可以写出化学方程式;
(3)根据X的结构可知,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键,根据AlN的性质可知它为原子晶体,所以晶体中含有共价键,据此答题;
(4)氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,它们都是原子晶体,所以氮化硼的熔点比AlN高,据此答题;
(5)晶体N原子位于晶胞体对角线的
处,将体心与下底面相对的两顶点相连可构成等腰三角形,距离最近的两个N原子相连的连线为该三角形的中位线,所以晶体中最近的两个N原子的距离为底面对角线的
,根据晶胞的密度可以求得晶胞边长,进而求得底面对角线的长度,据此可解题.
 ,氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO
,氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO- 3 |
| O | + 2 |
| 5-1 |
| 2 |
(2)根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子
| 1 |
| 8 |
| 1 |
| 2 |
(3)根据X的结构可知,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键,根据AlN的性质可知它为原子晶体,所以晶体中含有共价键,据此答题;
(4)氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,它们都是原子晶体,所以氮化硼的熔点比AlN高,据此答题;
(5)晶体N原子位于晶胞体对角线的
| 1 |
| 4 |
| 1 |
| 2 |
解答:
解:(1)氮是7号元素,价电子数是5,价电子排布图为 ,氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO
,氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO
,则其阳离子的化学式为:N
,其中心原子价电子对数为
=2,所以其中的氮原子按sp方式杂化,阳离子的构型为直线型,
故答案为: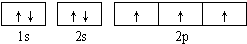 ;直线; sp;
;直线; sp;
(2)根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子
×8+
×6=4,所以X的化学式为AlN,根据元素守恒可以写出化学方程式为Al2O3+N2+3C=2AlN+3CO,故答案为:Al2O3+N2+3C=2AlN+3CO;
(3)根据X的结构可知,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键,根据AlN的性质可知它为原子晶体,所以晶体中含有共价键,所以BC正确,故答案为:BC;
(4)氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,它们都是原子晶体,所以氮化硼的熔点比AlN高,故答案为:氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能;
(5)晶体N原子位于晶胞体对角线的
处,将体心与下底面相对的两顶点相连可构成等腰三角形,距离最近的两个N原子相连的连线为该三角形的中位线,所以晶体中最近的两个N原子的距离为底面对角线的
,根据晶胞的密度ρ=
,可以求得晶胞边长为
,进而求得底面对角线的长度为
?
,所以晶体中最近的两个N原子的距离为
?
,故答案为:
?
cm.
 ,氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO
,氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO- 3 |
| O | + 2 |
| 5-1 |
| 2 |
故答案为:
 ;直线; sp;
;直线; sp;(2)根据X的晶体结构图可知,晶胞中含有氮原子为4,含有铝原子
| 1 |
| 8 |
| 1 |
| 2 |
(3)根据X的结构可知,每个铝和氮周围都有四个共价键,都达八电子稳定结构,而铝原子最外层原来只有三个电子,氮原子最外层有5个电子,所以在AlN中有配位键,根据AlN的性质可知它为原子晶体,所以晶体中含有共价键,所以BC正确,故答案为:BC;
(4)氮化硼与AlN相比,硼原子半径比铝原子半径小,所以键能就大,它们都是原子晶体,所以氮化硼的熔点比AlN高,故答案为:氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能;
(5)晶体N原子位于晶胞体对角线的
| 1 |
| 4 |
| 1 |
| 2 |
| ||
| 晶胞边长3 |
| 3 |
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
点评:本题考查了原子核外电子排布图、均摊法晶胞的计算、键能与性质的关系、以及晶胞结构的计算等知识,中等难度.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
“云蒸霞蔚”出自《世说新语?言语》,表示霞光透过云层的绚丽灿烂.从化学角度分析“云”属于下列分散系中的( )
| A、溶液 | B、胶体 |
| C、乳浊液 | D、悬浊液 |
 发展混合动力车是实施节能减排的重要措施之一.混合动力车的电动机目前一般使用的是镍氢电池.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液.镍氢电池充放电原理如图,其总反应式为:H2+2NiOOH
发展混合动力车是实施节能减排的重要措施之一.混合动力车的电动机目前一般使用的是镍氢电池.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液.镍氢电池充放电原理如图,其总反应式为:H2+2NiOOH| 放电 |
| 充电 |
| A、在上坡或加速时,每消耗22.4LH2,从电极甲流向电极乙的电子是2mol |
| B、在上坡或加速时,乙电极周围溶液的pH将减小 |
| C、在刹车和下坡时,溶液中的K+向乙电极迁移 |
| D、在刹车和下坡时,甲电极的电极反应式为2H2O+2e-═H2↑+2OH- |
下列各组元素性质递变情况错误的是( )
| A、P、S、Cl元素最高正化合价依次升高 |
| B、碱性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3 |
| C、S2-、Cl-、K+、Ca2+离子半径依次增大 |
| D、热稳定性:H2S>PH3>AsH3 |
在25℃时,将amol/L的氨水和0.01mol/L的盐酸溶液等体积混合,反应溶液呈中性,下列说法错误的是(忽略溶液混合体积的变化)( )
| A、溶液中有c(NH4+)=c(Cl-) | ||
| B、此时水的电离程度最大 | ||
C、此时溶液中氨水的物质的量浓度为
| ||
| D、a>0.01 |

 Ⅰ.今运动场馆大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED晶片,材质基本以GaAs(砷化镓)、InGaN(氮化铟镓)为主.砷化镓作为第三代半导体,以其为材料制造的灯泡寿命长.耗能少.
Ⅰ.今运动场馆大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED晶片,材质基本以GaAs(砷化镓)、InGaN(氮化铟镓)为主.砷化镓作为第三代半导体,以其为材料制造的灯泡寿命长.耗能少.