题目内容
13.下列说法错误的是( )| A. | H2O比H2S稳定,是因为H2O分子间存在氢键 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | 锂所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3 | |
| D. | I的原子半径大于Br,HBr比HI的热稳定性强 |
分析 A、稳定性是化学性质,是由分子内共价键的强弱决定;
B、非金属性越强最高价氧化物对应水化物的酸性越强;
C、元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
D、I的原子半径大于Br,所以H-I的键长比H-Br的键长长,其氢化物越稳定性差;
解答 解:A、稳定性是化学性质,是由分子内共价键的强弱决定,与氢键无关,故A错误;
B、元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性P>Si,所以H3PO4比H2SiO3的酸性强,故B正确;
C、元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,第二周期中除了O、F元素外非金属性最强的是N元素,所以酸性最强的是HNO3,故C正确;
D、I的原子半径大于Br,所以H-I的键长比H-Br的键长长,其氢化物越稳定性差,所以氢化物的稳定性HBr>HI,故D正确;
故选A.
点评 本题考查元素周期律,为高频考点,明确金属性、非金属性强弱与其最高氧化物水溶液酸碱性关系是解本题关键,注意规律中的反常现象,易错选项是C.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.用VSEPR 理论判断:
| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的形状 |
| NH4+ | 1 | sp3 | 三角锥形 |
| NCl3 | 0 | sp3 | 正四面体形 |
4.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑.以下解决能源问题的方法不当的是( )
| A. | 用木材作燃料 | B. | 用乙醇替代汽油 | C. | 开发风能 | D. | 开发地热 |
2.类比的思维方式在化学学习与研究中经常采用,但类比得到的结论是否正确最终要经过实验的验证.以下类比的结论正确的是( )
| A. | Na、K都是I A族的金属,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 | |
| B. | HCl的水溶液是强酸,推出HF的水溶液也是强酸 | |
| C. | 由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生 | |
| D. | 由“Cl2+H2O?HCl+HClO”反应可推出“F2+H2O?HF+HFO”反应也能发生 |
3.下列分子中所有原子一定处于同一平面的是( )
| A. | CH2=CH-CH=CH2 | B. | CH2=CH-C≡CH | C. |  | D. |  |
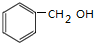
 ,该反应用于苯酚的定性检验和定量测定.
,该反应用于苯酚的定性检验和定量测定.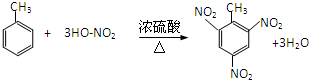 .
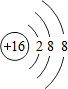
.
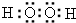 .
.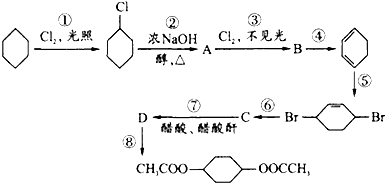
 ,C
,C .
.