题目内容
4.一定温度下,向a L密闭容器中加入2mol NO2气体,发生如下反应:2NO2(g)═2NO(g)+O2(g),此反应达到平衡状态的标志是( )| A. | 混合气体的密度不再变化 | |
| B. | 混合气体的颜色不变化 | |
| C. | 混合气体中NO2、NO、O2的物质的量之比为2:2:1 | |
| D. | 单位时间生成2n mol NO,同时消耗2n mol NO2 |
分析 可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析.
解答 解:A、混合气体的质量始终相等,体积相等,所以密度始终不变,混合气体的密度不再变化的状态,反应并不一定达到平衡,故A错误;
B、NO2是红棕色,混合气体颜色不变,说明二氧化氮的浓度不再变化,该现象能确定达到平衡,故B正确;
C、反应达到平衡时的各物质的物质的量与反应的初始物质的量以及反应的转化程度有关,混合气中NO2、NO、O2物质的量之比为2:2:1,不能确定是否达到平衡,故C错误;
D、单位时间内生成2nmolNO,同时生成2n molNO2,才能说明反应v正=v逆,达到平衡状态,生成2n mol NO,同时消耗2n mol NO2只能说明反应的一个方向,故D错误.
故选B.
点评 本题考查化学平衡状态的判断,题目难度不大,做题时注意分析化学方程式的前后计量数大小的关系.

练习册系列答案
相关题目
14.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2L的CHCl3含有的分子数为0.5NA | |
| B. | 28gSi晶体中含有Si-Si键的个数为4NA | |
| C. | 常温下,78g某浓度的乙炔的苯溶液中含碳原子数为6NA | |
| D. | 0.1 molCnH2n+2中含有的碳碳单键数为0.1nNA |
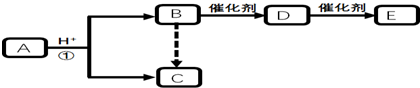
15. 2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
 2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )| A. | 分子式为C15H20O5 | B. | 具有较强的还原性 | ||
| C. | 易溶于水,乙醇和乙醚 | D. | 氧原子的化合价由-1和-2 |
12.下列说法正确的是( )
| A. | (NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 | |
| B. | 苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为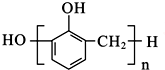 | |
| C. | 醋酸和硬脂酸互为同系物,C6H12和C9H18也一定互为同系物 | |
| D. | 迷迭香酸的结构为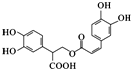 它可以发生酯化、水解但不能加成反应. 它可以发生酯化、水解但不能加成反应. |
19.下列有关推断正确的是( )
| A. | SO3 是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
9.下列物质属于电解质且能导电的是( )
| A. | 石墨 | B. | 液态HCl | C. | 葡萄糖 | D. | 熔融的Na2CO3 |
13.RbH是一种离子化合物,它跟水反应的方程式为:RbH+H2O=RbOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气,下列有关RbH的叙述错误的是( )
| A. | 灼烧RbH时,火焰有特殊颜色 | |
| B. | RbH中H+半径比Li+半径小 | |
| C. | 跟液氨反应时,有RbNH2生成 | |
| D. | 在Na、K、Rb三种单质中,Rb的熔点最高 |