题目内容
15. 2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )| A. | 分子式为C15H20O5 | B. | 具有较强的还原性 | ||
| C. | 易溶于水,乙醇和乙醚 | D. | 氧原子的化合价由-1和-2 |
分析 A.根据结构简式确定分子式;
B.该物质中具有过氧键,具有过氧化物的性质;
C.该物质中不含亲水基,含有憎水剂;
D.该分子中醚键、酯基中的O元素化合价为-2价,过氧键中O元素化合价为-1价.
解答 解:A.根据结构简式知,分子式为C15H22O5,故A错误;
B.该物质中具有过氧键,具有过氧化物的性质,具有强氧化性,故B错误;
C.该物质中不含亲水基,含有憎水剂,所以不易溶于水,易溶于乙醇和乙醚,故C错误;
D.该分子中醚键、酯基中的O元素化合价为-2价,过氧键中O元素化合价为-1价,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,涉及分子式确定、溶解性、化合价等知识点,侧重考查学生分析判断及知识迁移能力,易错选项是D.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
10.雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO$?_{△}^{催化剂}$2CO2(g)+N2(g)△H<0
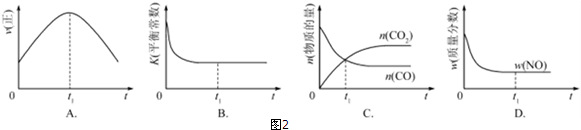
①该反应的速率时间图象如图1中甲图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图1中乙图所示.以下说法正确的是BC(填对应字母).
A.a1>a2 B.b1<b2 C.t1>t2
D.乙图中阴影部分面积更大
E.甲图中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,图2示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表.
①该反应是吸热反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图3是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
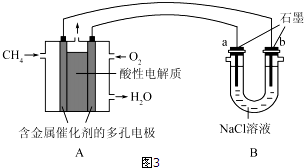
①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+;
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO$?_{△}^{催化剂}$2CO2(g)+N2(g)△H<0
①该反应的速率时间图象如图1中甲图所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图1中乙图所示.以下说法正确的是BC(填对应字母).

A.a1>a2 B.b1<b2 C.t1>t2
D.乙图中阴影部分面积更大
E.甲图中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,图2示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号).

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表.
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O═CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图3是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).

①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+;
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
7.下列有关物质性质的说法正确的是( )
| A. | 铝与Fe2O3发生铝热反应后固体物质质量不变 | |
| B. | Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 | |
| C. | 过量的铜与浓硝酸反应可生成NO | |
| D. | 由于铝元素和铁元素都有+3价,由2Al+6HCl2═AlCl3+3H2↑可知:2Fe+6HCl2═FeCl3+3H2↑ |
4.一定温度下,向a L密闭容器中加入2mol NO2气体,发生如下反应:2NO2(g)═2NO(g)+O2(g),此反应达到平衡状态的标志是( )
| A. | 混合气体的密度不再变化 | |
| B. | 混合气体的颜色不变化 | |
| C. | 混合气体中NO2、NO、O2的物质的量之比为2:2:1 | |
| D. | 单位时间生成2n mol NO,同时消耗2n mol NO2 |
5.在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)═CH3OH(g);△H<0.2min时只改变一个条件,反应情况如下表:下列说法不正确的是( )
| 时间 | c(CO)/mol/L | c(H2)/mol/L | c(CH3OH)/mol/L |
| 起始 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.2 |
| 第4min | 0.4 | 1.8 | 0.6 |
| 第6min | 0.4 | 1.8 | 0.6 |
| A. | 第4 min至第6 min该化学反应处于平衡状态 | |
| B. | 第2 min时,如果只改变某一条件,则改变的条件可能是降低温度 | |
| C. | 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 | |
| D. | 第6 min时,其他条件不变,如果升高温度,反应速率增大 |
 .
.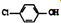 )的酸性废水,可利用微生物电池法除去,其原理如图2所示
)的酸性废水,可利用微生物电池法除去,其原理如图2所示 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-
-OH+Cl-