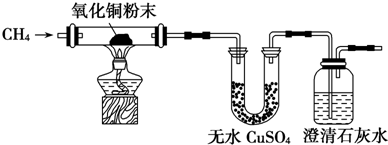
题目内容
13.RbH是一种离子化合物,它跟水反应的方程式为:RbH+H2O=RbOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气,下列有关RbH的叙述错误的是( )| A. | 灼烧RbH时,火焰有特殊颜色 | |
| B. | RbH中H+半径比Li+半径小 | |
| C. | 跟液氨反应时,有RbNH2生成 | |
| D. | 在Na、K、Rb三种单质中,Rb的熔点最高 |
分析 A.碱金属元素的焰色反应都呈现一定的颜色;
B.离子的电子层数越多其离子半径越大;
C.根据RbH和水反应知,该反应生成氢气,则与液氨反应生成RbNH2;
D.碱金属单质中其熔点随着原子序数增大而减小.
解答 解:A.碱金属元素的焰色反应都呈现一定的颜色,所以Rb的焰色反应有颜色,故A正确;
B.离子的电子层数越多其离子半径越大,锂离子电子层数大于氢离子,所以RbH中H+半径比Li+半径小,故B正确;
C.根据RbH和水反应知,该反应生成氢气,则与液氨反应生成RbNH2,故C正确;
D.碱金属单质中其熔点随着原子序数增大而减小,所以Rb熔点最低,故D错误;
故选D.
点评 本题考查碱金属元素结构和性质,为高频考点,明确原子结构、元素周期律、物质性质是解本题关键,侧重考查学生分析判断及知识迁移能力,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
4.一定温度下,向a L密闭容器中加入2mol NO2气体,发生如下反应:2NO2(g)═2NO(g)+O2(g),此反应达到平衡状态的标志是( )
| A. | 混合气体的密度不再变化 | |
| B. | 混合气体的颜色不变化 | |
| C. | 混合气体中NO2、NO、O2的物质的量之比为2:2:1 | |
| D. | 单位时间生成2n mol NO,同时消耗2n mol NO2 |
1.下列实验能达到实验目的是( )
| A. |  观察铁的吸氧腐蚀 | B. |  比较氯、碳、硅的非金属性 | ||
| C. |  实验室蒸馏石油 | D. |  甲烷与氯气的取代反应 |
18.下列物质能发生消去反应的是( )
| A. | CH3Cl | B. | (CH3)3CCH2Cl | C. |  | D. |  |
5.在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)═CH3OH(g);△H<0.2min时只改变一个条件,反应情况如下表:下列说法不正确的是( )
| 时间 | c(CO)/mol/L | c(H2)/mol/L | c(CH3OH)/mol/L |
| 起始 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.2 |
| 第4min | 0.4 | 1.8 | 0.6 |
| 第6min | 0.4 | 1.8 | 0.6 |
| A. | 第4 min至第6 min该化学反应处于平衡状态 | |
| B. | 第2 min时,如果只改变某一条件,则改变的条件可能是降低温度 | |
| C. | 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 | |
| D. | 第6 min时,其他条件不变,如果升高温度,反应速率增大 |
2.甲基丁烷和氯气发生取代反应时,能生成一氯化物异构体的数目是( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
13. 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
(1)滴定原理为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色.
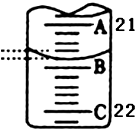
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为21.40mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是BCD
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积.
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡.
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗.
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定.
(5)根据所给数据,写出计算H2C2O4的物质的量浓度的表达式(不必化简):C=$\frac{\frac{5}{2}×c×\frac{(25.35+25.30)}{2}×10{\;}^{-3}}{V×1{0}^{-3}}$mol/L.
 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.(1)滴定原理为:6H++2MnO4-+5H2C2O4═2Mn2++10CO2↑+8H2O(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在酸式(填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色.
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为21.40mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.32 | 25.35 | 25.30 |
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积.
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡.
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗.
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定.
(5)根据所给数据,写出计算H2C2O4的物质的量浓度的表达式(不必化简):C=$\frac{\frac{5}{2}×c×\frac{(25.35+25.30)}{2}×10{\;}^{-3}}{V×1{0}^{-3}}$mol/L.