题目内容
3.NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )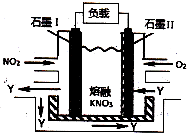
| A. | 放电时,N03-向石墨Ⅱ电极迁移 | |
| B. | 石墨Ⅱ附近发生的反应为:NO+O2+e-═NO3- | |
| C. | 电池总反应式为:4NO2+O2═2N2O5 | |
| D. | 当外电路通过4mol e-,负极上共产生2mol N2O5 |
分析 NO2、O2和熔融KNO3可制作燃料电池,NO2作燃料、O2作氧化剂,所以石墨I为负极、石墨II为正极,石墨I电极上生成氧化物Y,因为负极上失电子,所以Y是五氧化二氮,则石墨I电极反应式为NO2+NO3--e-=N2O5,石墨II电极反应式为O2+2N2O5+4e-=4NO3-,电池反应式为:4NO2+O2═2N2O5,放电时,电解质中阴离子向负极移动、阳离子向正极移动,结合转移电子和各物质之间的关系式计算.
解答 解:NO2、O2和熔融KNO3可制作燃料电池,NO2作燃料、O2作氧化剂,所以石墨I为负极、石墨II为正极,石墨I电极上生成氧化物Y,因为负极上失电子,所以Y是五氧化二氮,则石墨I电极反应式为NO2+NO3--e-=N2O5,石墨II电极反应式为O2+2N2O5+4e-=4NO3-,电池反应式为:4NO2+O2═2N2O5,放电时,电解质中阴离子向负极移动、阳离子向正极移动,
A.放电时,电解质中阴离子向负极移动、阳离子向正极移动,所以放电时,N03-向石墨I电极迁移,故A错误;
B.石墨II是正极,电极反应式为O2+2N2O5+4e-=4NO3-,故B错误;
C.根据以上分析知,电池反应式为:4NO2+O2═2N2O5,故C正确;
D.根据NO2+NO3--e-=N2O5知,当外电路通过4mol e-,负极上共产生4mol N2O5,故D错误;
故选C.
点评 本题考查化学电源新型电池,为高频考点,明确原电池正负极上得失电子、元素化合价变化及离子移动方向等知识点是解本题关键,难点是电极反应式的书写,注意Y成分的正确判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.氧化钙在2973K时熔化,而NaCl在1074K时熔化,二者的离子间距和晶体结构都类似,有关它们熔点差别较大的原因叙述不正确的是( )
| A. | 氧化钙晶体中阴、阳离子所带电荷数多 | |
| B. | 氧化钙晶格能比氯化钠的晶格能大 | |
| C. | 两种晶体的晶胞结构类型不同 | |
| D. | 氧化钙、氯化钠的离子间距类似情况下,晶格能主要由阴、阳离子所带电荷数决定 |
18.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
| A. | 一个D2O分子所含的中子数为8 | B. | NH3的结构式为  | ||
| C. | HF、HCl、HBr、HI的熔沸点逐渐升高 | D. | 热稳定性:H2S>HF |
8. 乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )
乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )
 乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )
乙氧基甲叉丙二酸二乙酯是有机合成原料,用于医药、染料等产品制造,其结构简式如图所示,下列有关叙述错误的是( )| A. | 乙氧基甲叉丙二酸的化学式为C6H6O5 | |
| B. | 1mol乙氧基甲叉丙二酸二乙酯在酸性条件下水解得到1mol乙醇 | |
| C. | 1mol乙氧基甲叉丙二酸最多能消耗2molNaOH | |
| D. | 乙氧基甲叉丙二酸既能发生取代反应又能发生氧化反应 |
15.已知33As、35Br位于同一周期,下列关系正确的是( )
| A. | 原子半径:As>Cl>Br | B. | 热稳定性:HCl>AsH3>HBr | ||
| C. | 还原性:As3->S2->Cl- | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
12.下列叙述错误的是( )
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | 1H和2H是不同的核素,它们的化学性质基本相同 | |
| C. | 14C和14N的质量数相等,它们的中子数不等 | |
| D. | 6Li和7Li的电子数相等,中子数也相等 |
13.下列关于实验的描述不正确的是( )
| A. | 使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏低 | |
| B. | 过滤时,玻璃棒靠在三层滤纸边沿稍下方 | |
| C. | 在镀件上电镀铜时,可用金属铜作阳极 | |
| D. | 在用Fe(OH)3胶体溶液做电泳实验时,阴极区红色加深,可知Fe(OH)3胶体粒子带正电荷 |
 $\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
$\stackrel{H_{2}O}{→}$2RCOOH(其中R是烃基)
 ,CH2=C(CH3)CH=CH2.
,CH2=C(CH3)CH=CH2.